Dall’Ecografia all’ Ecografia Volumetrica Automizzata
Nei seni densi e molto densi la sensibilità della mammografia nel riconoscere precocemente il tumore non supera il 60%.
Ecografia associata alla mammografia migliora la sensibilità nelle mammelle dense: una metanalisi
- Yuan WH & al.
- Secondo i risultati di un’ampia metanalisi, ecografia più mammografia sono più sensibili, ma meno specifiche, nell’individuare i tumori mammari nelle mammelle dense rispetto alla sola mammografia.
Perché è importante
- Lo studio presenta l’accuratezza e gli aspetti negativi dell’uso di entrambe le tecniche nelle donne con mammelle dense.
Disegno dello studio
- Metanalisi di 21 studi (sperimentazioni randomizzate e controllate, studi di coorte retrospettivi e prospettici condotti in tutto il mondo), comprendenti >30.000 donne con mammelle dense.
- Gli studi hanno soddisfatto i criteri di inclusione dopo una ricerca su Medline, Cochrane, EMBASE e Google Scholar.
- Finanziamento: nessuno.
Risultati principali
- Ecografia più mammografia rispetto a sola mammografia: maggiore sensibilità, 96% vs. 74%; rapporto di rischio, 0,699 (P<0,001); peggiore specificità, 87%vs.93%;rapporto di rischio, 1,060 (P=0,001).
- L’ecografia di follow-up dopo una mammografia iniziale negativa ha evidenziato un’alta sensibilità aggregata del 96% e una specificità dell’88%.
- I risultati erano simili nell’analisi di sottogruppo in base a Paese, metodo ecografico e tempistica dell’ecografia.
Limiti
- Inclusione di studi di coorte osservazionali.
- Eterogeneità tra gli studi.
Ruolo dell’ecografia nello screening
Sebbene la mammografia sia uno strumento di screening efficace, i dati suggeriscono che spesso è meno sensibile nel rilevare il cancro nel tessuto mammario denso mammograficamente. L’uso degli US per lo screening non è stato generalmente raccomandato per le donne ad alto rischio con seno denso. Sebbene alcuni progetti di ricerca abbiano riportato risultati ragionevoli dallo screening mammario è necessario risolvere una serie di gravi problemi prima che la pratica venga raccomandata per l’applicazione generale. I fattori includono variabilità interosservatore, variabilità intraosservatore, sensibilità sconosciuta e bassa specificità (che porta a numerose valutazioni bioptiche di lesioni benigne). [10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29] Kolb et al e Buchberger et al hanno scoperto che , se eseguita con attenzione, l’ecografia può essere utile per rilevare il cancro al seno occulto in seni densi. [30, 31] Uno studio retrospettivo su 48.251 donne sottoposte a mammografia digitale a campo pieno ed ecografia per lo screening del cancro al seno ha rilevato che l’ecografia da sola è soddisfacente per tutte le fasce d’età, sebbene la mammografia digitale a campo pieno più la rilevazione assistita da computer più gli ultrasuoni siano risultati lo screening perfetto metodo. La rilevabilità del cancro al seno mediante ultrasuoni (96,5%) o mammografia digitale a campo pieno più rilevamento assistito da computer più ultrasuoni (100%) era superiore a quella della mammografia digitale a tutto campo (87,1%) o della mammografia digitale a campo pieno più computer rilevamento assistito (88,3%). [1] Lo studio Newtwork 6666 dell’American College of Radiology Imaging (ACRIN 6666) ha rilevato che il tasso di rilevamento del cancro con gli ultrasuoni è paragonabile a quello con la mammografia (58 su 111, vs 59 su 111, rispettivamente), con una percentuale maggiore di tumori invasivi rilevati da ecografia rispetto alla mammografia (91,4% vs 69,5%, rispettivamente), ma i falsi positivi erano più comuni con gli ultrasuoni. Il numero di schermi ecografici per rilevare un cancro era 129 e per la mammografia 127. [2] Gli ultrasuoni sono generalmente riconosciuti come una modalità altamente dipendente dall’operatore che richiede un professionista esperto, esami di alta qualità e attrezzature all’avanguardia. Attualmente, si raccomanda di riservare l’uso degli US nello screening per la patologia mammaria a situazioni speciali, come per le pazienti altamente ansiose che ne fanno richiesta e per le donne che hanno una storia di carcinoma mammograficamente occulto.
- Author: Paul R Fisher, MD; Chief Editor: Eugene C Lin, MD more..
Although mammography is an effective screening tool, data suggest that it is often less sensitive in detecting cancer in mammographically dense breast tissue. The use of US for screening for breast disease has not been generally recommended for high-risk women with dense breasts.
Although some research projects have reported reasonable results from US breast screening, a number of serious issues need to be solved before the practice is recommended for general application. Factors include interobserver variability, intraobserver variability, unknown sensitivity, and low specificity (leading to numerous biopsy evaluations of benign lesions). [10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29] Kolb et al and Buchberger et al found that, when performed carefully, ultrasonography may be useful in detecting occult breast cancer in dense breasts. [30, 31]
A retrospective study of 48,251 women who underwent full-field digital mammography and ultrasound for breast cancer screening found that ultrasound alone is satisfactory for all age groups, although full-field digital mammography plus computer-aided detection plus ultrasound was found to be the perfect screening method. The detectability of breast cancer by ultrasound (96.5%) or full-field digital mammography plus computer-aided detection plus ultrasound (100%) was superior to that of full-field digital mammography (87.1%) or full-field digital mammography plus computer-aided detection (88.3%). [1]
The American College of Radiology Imaging Newtwork 6666 study (ACRIN 6666) found that the cancer detection rate with ultrasound is comparable to that with mammography (58 of 111, vs 59 of 111, respectively), with a greater proportion of invasive cancers being detected by ultrasound than by mammography (91.4% vs 69.5%, respectively), but false positives were more common with ultrasound. The number of ultrasound screens to detect one cancer was 129, and for mammography, 127. [2
US is generally acknowledged to be a highly operator dependent modality that requires a skilled practitioner, high-quality examinations, and state-of-the-art equipment. Currently, it is recommended that the use of US in screening for breast disease be reserved for special situations, such as for highly anxious patients who request it and for women who have a history of mammographically occult carcinoma.
In view of the results of these studies, a prospective, multicenter study was carried out to examine the role of US in breast cancer screening. A large multicenter study supported by the Avon Foundation and the National Institutes of Health was created through the American College of Radiology Imaging Network (ACRIN). [32] In this project, a protocol to assess the efficacy of screening breast US was implemented in 14 imaging centers to better define the role of US in breast cancer screening. The study reported higher cancer detection in high-risk women that underwent annual ultrasound screening in addition to mammography compared to those that underwent mammography alone. [33] (More information is available on the ACRIN Web site.) In September 2012, the U.S. Food and Drug Administration approved the first ultrasound system, the somo-v Automated Breast Ultrasound System (ABUS), for breast cancer screening in combination with standard mammography specifically for women with dense breast tissue. [34] ABUS is indicated for women with a negative mammogram, no breast cancer symptoms and no previous breast intervention such as surgery or biopsy.
A study of the positive predictive value (PPV) of bilateral whole-breast ultrasonography (BWBU) for detection of synchronous breast lesions on initial diagnosis of breast cancer found that BWBU can detect additional synchronous malignancy with a relatively high PPV, especially when mammography findings are correlated with ultrasound findings. In 75 patients who had synchronous lesions, PPV for additional biopsy was 25.7% (18 of 70). The PPV for synchronous lesions detected both on mammography and BWBU was 76.9% (10 of 13) and detected only on BWBU was 14.3% (7 of 49). A mass with calcification on mammography presentation (P< 0.01), presence of calcification among the ultrasonography findings (P< 0.01), and high Breast Imaging Reporting and Data System final assessment (P< 0.01) were imaging factors that were associated with malignancy in the additional synchronous lesion. [35]
In a retrospective study of women younger than 40 years identified with invasive cancer (N = 27) or ductal carcinoma in situ (N = 3), ultrasonography was found to be reliable as the primary imaging modality. Of the 30 women, 28 underwent mammography (graded as uncertain, suspicious, or malignant in the majority), and malignancy was missed in one patient. All 30 patients underwent ultrasonography (reported as uncertain, suspicious, or malignant, an indication for diagnostic core biopsy), and ultrasonography alone did not miss any cancers but did fail to detect multifocal disease in one patient. [36]
Breast Imaging Reporting and Data System
As mentioned, ultrasonography is highly operator dependent. Therefore, its efficacy depends on obtaining images that are of high technical quality, on interpreting those images correctly, and on clearly reporting the results.
Baker et al and Rahbar et al demonstrated that observer variability varies considerably in the description and assessment of solid masses demonstrated on sonograms. [37, 38] More uniform and more clearly understandable examination reports are needed to improve patient care and to facilitate research in the use of breast US.
BI-RADS-US
Mendelsohn et al published the results of their initial work in creating a standardized breast US lexicon, [39] and the American College of Radiology (ACR) published the Breast Imaging Reporting and Data System (BI-RADS) Atlas. [40] This latter document is an extended version of the Third Edition of the BI-RADS lexicon used in mammography. The BI-RADS Atlas includes new sections on breast US (ACR BI-RADS–US) and MRI (ACR BI-RADS–MRI). ACR BI-RADS–US may help standardize the terms used for characterizing and reporting lesions, thereby facilitating patient care, the characterization of lesions, and the development of possible screening applications.
ACR BI-RADS–US provides terms that describe the following features or findings on breast US examinations: shape, orientation, margin, boundary, echo pattern, posterior acoustic features, and surrounding tissue for masses; breast calcifications (which are poorly characterized by US); special cases, such as complicated cysts and intramammary lymph nodes; vascularity; and assessment categories.
Distinguishing Benign Masses from Malignant Masses
Originally, ultrasonography was primarily used to distinguish simple cysts, which did not require sampling, from solid masses that were usually examined with biopsy. In many cases, the results of these biopsies were benign. Improving equipment and scanning techniques have helped expand the applications of breast US. Linear-array high-frequency (7.5 MHz or higher center frequency) transducers are generally used.
Recent innovations include electronically steered compound imaging and tissue harmonic imaging. Contrast-enhanced Doppler US and 3-dimensional imaging are experimental techniques that are under investigation. [42, 43, 44, 45]
Benign, Indeterminate, and Malignant Nodules
In a landmark study, Stavros et al established US criteria for characterizing solid breast masses. [46] This work was facilitated by evolving technical improvements in US equipment that provided better resolution and images. They demonstrated that US may be used to accurately classify some solid lesions as benign, allowing follow-up with imaging rather than biopsy. They used high-resolution transducers, which were state-of-the-art at that time, and performed examinations in both radial and antiradial planes. The investigators also focused on the evaluation of suspected areas in the transverse and longitudinal planes.
Stavros et al proposed a US scheme for prospectively classifying breast nodules into 1 of 3 categories [46] :
- Benign
- Indeterminate
- Malignant
To be classified as benign, a nodule had to have no malignant characteristics. In addition, 1 of the following 3 combinations of benign characteristics had to be demonstrated:
- Intense uniform hyperechogenicity
- Ellipsoid or wider-than-tall (parallel) orientation, along with a thin, echogenic capsule
- 2 or 3 gentle lobulations and a thin, echogenic capsule
A nodule was classified as indeterminate by default if it had no malignant characteristics and none of the 3 benign characteristic combinations listed above.
To be classified as malignant, a mass needed to have any of the following characteristics:
- Spiculated contour
- Taller-than-wide (not parallel) orientation
- Angular margins
- Marked hypoechogenicity
- Posterior acoustic shadowing
- Punctate calcifications
- Duct extension
- Branch pattern
- Microlobulation
Of the 424 lesions that Stavros et al prospectively classified as benign by means of US, only 2 were found to be malignant at biopsy, resulting in a negative predictive value of 99.5% in a population with a cancer prevalence of 16.7%. [46] Of the 125 lesions found to be malignant at biopsy, 123 were classified as malignant or indeterminate with US, yielding a sensitivity of 98.4%. Biopsy is indicated for nodules that are classified on US as either malignant or indeterminate.
Of the 424 lesions that Stavros et al prospectively classified as benign by means of US, only 2 were found to be malignant at biopsy, resulting in a negative predictive value of 99.5% in a population with a cancer prevalence of 16.7%. [46] Of the 125 lesions found to be malignant at biopsy, 123 were classified as malignant or indeterminate with US, yielding a sensitivity of 98.4%. Biopsy is indicated for nodules that are classified on US as either malignant or indeterminate.
Skaane et al found that US could distinguish fibroadenomas from invasive ductal carcinoma. [47] Others who have studied the characteristics of benign and malignant masses by US examination include Zonderland et al and Rahbar et al. [48, 38]
Typical US Patterns of Specific Types of Breast Carcinomas
The appearance of specific types of breast carcinoma have been studied. Although appearances vary greatly, some patterns are typical.
Mucin-containing carcinomas are often circumscribed but may have irregular margins. These lesions may be either hypoechoic or isoechoic relative to subcutaneous fat. In a study of these carcinomas by Conant et al involving 8 patients, US showed hypoechoic, solid masses in all of their cases. [49] The lesions demonstrated acoustic shadowing or increased acoustic enhancement. Some lesions had circumscribed margins, and some were not circumscribed.
Tubular carcinoma is usually hypoechoic but is without circumscribed margins and acoustic posterior shadowing. Invasive ductal carcinoma typically appears as an irregularly shaped mass with spiculated margins with shadowing and architectural distortion of adjacent breast tissue. This lesion may contain malignant microcalcifications.
Invasive lobular carcinoma often does not cause a desmoplastic reaction. This type is frequently missed on mammography and may be difficult to see on sonograms. Butler et al reported that these lesions were ultrasonographically occult in 12% of their cases. [50] In approximately 60% of cases, it appeared as a heterogeneous, hypoechoic mass with angular or ill-defined margins and posterior acoustic shadowing. In 15% of cases, US demonstrated focal shadowing without a discrete mass; in 12% of cases, US showed a lobulated, circumscribed mass.
Medullary carcinoma often appears as a hypoechoic mass with acoustic enhancement (increased through transmission). It may be mistaken for a cyst on US.
Soo et al studied papillary carcinoma of the breast; they found that the cystic in situ form may appear as either a solid mass or a complex cystic mass with an internal solid component. [51] In both types, acoustic enhancement tends to be increased. Doppler study may demonstrate intratumoral blood flow. Invasive papillary carcinoma usually appears as a solid mass, although it may also appear as a complex cystic and solid mass.
Ductal carcinoma in situ of the breast often appears as suggestive microcalcifications on mammography. However, it may occasionally appear as a solid mass on ultrasound.
Characteristic Benign Masses
Many masses that are demonstrated on mammograms require biopsy to determine whether they are benign. Taylor et al reported that the use of US in conjunction with mammography increased specificity from 51% to 66% in a population with a malignancy prevalence of 31%. [52] This improvement could significantly reduce the biopsy rate of benign lesions. Breast US often reveals unexpected benign lesions.
Many benign breast conditions have a nonspecific appearance on US. However, some masses, such as simple cysts, sebaceous cysts, and intramammary lymph nodes, have a characteristic appearance that suggests a specific diagnosis. Almost all highly echogenic masses are benign.
If color Doppler imaging demonstrates blood flow within the contents of a complex cyst or dilated duct, then these contents consist of solid tissue rather then just debris, blood clot, or echogenic fluid. However, we have seen solid tumors that lack demonstrable blood flow on color Doppler imaging. Several investigators reviewed the ability of color Doppler US or contrast-enhanced Doppler US to distinguish benign from malignant lesions. The results were variable; Doppler US is not generally used to distinguish benign from malignant solid breast masses.
Ultrasound-Guided Procedures and Treatments
Ultrasonography is used to guide procedures such as cyst aspiration, percutaneous biopsy, needle localization of masses for surgical excision, abscess drainage in selected cases, and therapeutic radiofrequency or cryoablation.
Ultrasonography is highly accurate in diagnosing a simple cyst, and it is helpful in evaluating some complex cysts. Usually, a simple cyst is not aspirated unless they it is symptomatic or the patient has persistent psychological concerns about it. Complex cysts or suspected abscesses may be aspirated.
Berg et al reviewed their experience with the US-pathologic correlation of cystic lesions and found that all clustered microcysts were benign, but they cautioned that further study is required. [53] They recommended that biopsy be performed in cases involving (1) cystic lesions with thick, indistinct walls and/or thick septations (0.5 mm); (2) intracystic masses; and (3) predominantly solid masses with eccentric cystic foci. These recommendations were based on the fact that, in their series, 18 of 79 of such complex cystic lesions proved to be malignant.
If it is uncertain whether a nodule seen on US is a complex cyst or solid mass, US-guided aspiration of the cyst is often performed. This procedure is also performed if the appearance of a complex cyst on US is of concern. The aspirate may be sent for cytologic evaluation, though there is no general consensus about the indications for cytology. Some clinicians send only the fluid for analysis if it is bloody.
Parker et al reported excellent concordance between the results of US-guided automated core biopsy with a 14-gauge needle and surgical resection in 49 lesions. [54] US provides effective guidance for percutaneous breast biopsy without ionizing radiation. It also offers the advantages of real-time visualization of the needle and target lesion, multidirectional imaging, and low cost. With US, the patient does not need to undergo mammographic compression; in addition, with US, the examination may usually be performed with the patient recumbent rather than sitting, as is often the case with procedures involving mammographic guidance. However, US is not appropriate for guidance in all situations. For instance, microcalcifications often cannot be localized with US; in addition, not all masses seen on mammography can be seen with US.
Other biopsy devices, such as vacuum-assisted devices, have been developed for use with US guidance. Occasionally, it may be difficult to find the area in the breast where core biopsy was previously performed. This may be a problem if the pathologic results from the biopsy sample and other factors indicate that excisional biopsy or lumpectomy is needed. After a patient receives preoperative neoadjuvant chemotherapy, the tumor may become occult, making it difficult to localize for lumpectomy. For these reasons, various US techniques to mark the biopsy or tumor site have been developed. These include the deployment of coils, clips, or wires.
US-guided fine-needle aspiration biopsy (FNAB) of solid nodules has been used at many centers. Some advantages are that it is relatively easy for a skilled practitioner to perform and that the results are quickly obtained if a cytopathologist is available. For good results, the person performing the FNAB and the cytopathologist must be skilled. Some groups have achieved excellent results. However, in a study by Pisano et al involving 18 institutions, US-guided or stereotactically guided FNAB yielded a 10% insufficient-sample rate for US-guided FNAB of masses. [55] This finding does not compare favorably with results of US-guided core biopsy or US-guided needle localization. [56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69]

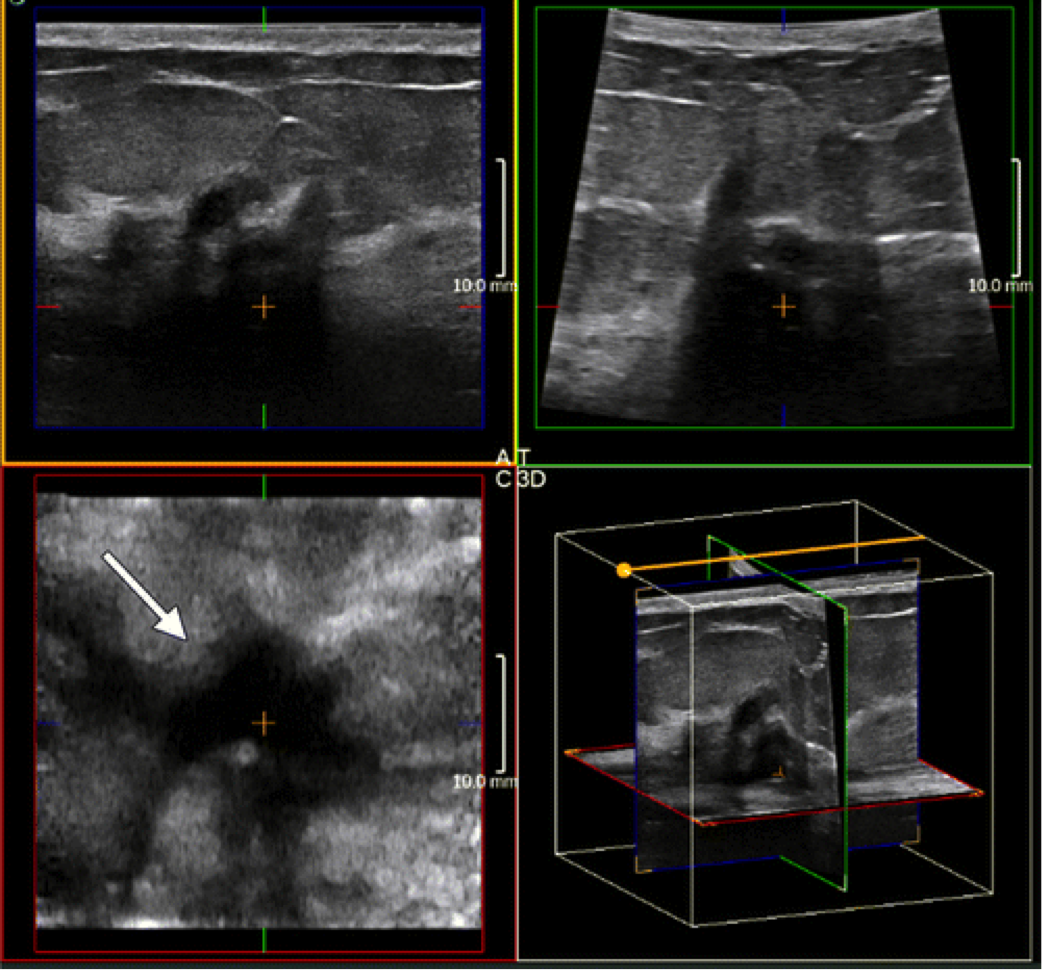
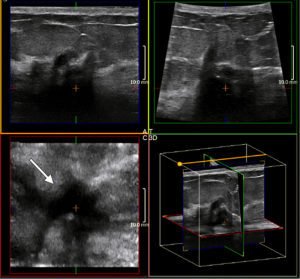
Ecografia tridimensionale 3D
Nuove possibilità sono legate alla introduzione dell’ ECOGRAFIA 3D nei seni densi, la sonda volumetrica automatizzata consente una straordinaria visualizzazione dei noduli mammari secondo prospettive che permettono di ricostruire virtualmente il volume, la superficie e l’aspetto dei noduli.
Trasduttori 3D manuali e automatizzati sono ora disponibili per l’uso in imaging del seno. Con una unica scansione del fascio di ultrasuoni, una immagine automizzata e ricostruita 3D può essere formata nei piani coronali, sagittali, e trasversale, permettendo una valutazione più accurata della massa delle strutture anatomiche della parete e dei margini del nodulo e dell’infiltrazione nel tessuto circostante L’analisi dei margini dei noduli può rilevare la presenza di spiculazioni, un elemento di notevole rischio ma è anche vero che la proiezione ottimale per valutare le spiculazioni è la scansione coronale per l’appunto visibile solo con ricostruzione tridimensionale quindi la possibilità di visualizzare quanto più spiculazioni possibili e offre sicuramente un guadagno diagnostico (a tale scopo preme precisare che la risoluzione della scansione coronale non ha come nei vecchi metodi di acquisizione tridimensionale ed in particolare quelli manuali una perdita di informazione sostanziale perché essendo la mammella un organo fermo si può fare un’acquisizione tridimensionale con metodica “slow” che permette un minor interpolazione trilineare per riempire tutti gli spazi vuoti.

Le problematiche dell’Abus

• tecnica di esecuzione
• tempi di esecuzione
• curva di apprendimento
• tempi di lettura
• validità scientifica / applicabilità allo screening
L’esame è eseguito dal TSRM
– relativamente facile/riproducibile, ma non banale
– maggiore completezza,
– sistematicità del campo esaminato
L’ABUS
– applicabilità allo screening
– sensibilità eccellente
– problema di specificità (?)
– necessità di nuovi studi /dati • studi collaborativi prospettici in centri di screening di alto flusso • confronto MD, DBT, EMAV • valutazione fattibilità, costo/efficacia • studio di strategie / protocolli innovativi di selezione casi e flussi di lavoro
– formazione
– richiede una innovazione pesante nei percorsi / flussi di lavoro screening
– risorse / personale (TSRM e medico) – risorse apparecchiature / archiviazione / flussi informatici (RIS / PACS / workstation integrate)
Screening ecografico
A causa delle note limitazioni della mammografia, soprattutto nelle donne con tessuto mammario denso, lo screening supplementare con ecografia, sta sempre più guadagnando una diffusa accettazione. Numerosi studi hanno dimostrato che l’aggiunta dell’ ecografia in donne con tessuto mammario denso alla mammografia diagnosticherà ulteriori 2,3-4,6 cancri occulti alla mammografia per 1000 donne ( 72 – 80 ). Berg e colleghi ( 82 ) hanno recentemente dimostrato che l’utilizzo dell’ecografia supplementare nelle donne a medio e ad alto rischio con seno mammograficamente denso ha permesso il rilevamento di ulteriori 3,7 tumori ogni 1000 donne sottoposte a screening.
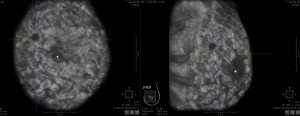
La tecnica Automatizzata è una alternativa di recente sviluppo per lo screening ecografico del seno, in cui standardizzate immagini possono essere facilmente ottenute . Il Sistema ecografico automizzato dell’intero seno utilizza un’unità ecografica standard e un trasduttore lineare-array collegato a un braccio meccanico guidato da computer con proiezioni dedicate mediante un’ampia trasduttore di 15-cm ( 84 , 85 ). Con questi sistemi, immagini sagittali, trasversale e coronale si ottengono, disponibili per la successiva revisione da parte del medico, con ricostruzione 3D associata. Tra i vantaggi, una minore dipendenza dell’operatore, maggiore efficienza-efficacia del medico, e una maggiore riproducibilità, che potrebbe aiutare nel follow-up delle lesioni. Pochi studi riguardanti le prestazioni di 3D US nel seno esistono, ma uno studio preliminare ha dimostrato una migliore caratterizzazione delle lesioni maligne ( 35 ). e un ruolo potenziale nella valutazione della risposta del tumore alla chemioterapia neoadiuvante. Uno studio multicentrico ha dimostrato che il sistema automatizzato ecografico può diagnosticare un ulteriore 3,6 cancro per 1000 donne sottoposte a screening, simili però ai risultati ecografici eseguiti manulmente dall’operatore ( 85 ). Tuttavia, gli svantaggi includono la limitata capacità di esplorare l’intera mammella, in particolare le regioni posteriori di grandi seni, revisione in termini di tempo di un gran numero di immagini da parte del medico, e la necessità di richiamare le pazienti per un secondo esame ecografico e rivalutare i risultati dubbi. Inoltre, alcuni ricercatori hanno cominciato a confrontare l’uso della tecnica manuale con il sistema automatizzato. Uno studio di Chang et al ( 86 ) ha dimostrato che su 14 cancri inizialmente rilevati allo screening ecografico manuale , solo il 57% -79% sono state rilevati anche da tre lettori su immagini whole-seno automatizzati, con due cancri persi da tutti e tre i lettori , ciascuno tumore era meno di 1 cm di dimensioni.
L’innovativo sistema di diagnosi del tumore della mammella per le donne con tessuto mammario denso.La mammografia potrebbe non rilevare oltre un terzo dei tumori laddove il tessuto mammario è particolarmente denso. Il sistema ABUS (Automated Breast Ultrasound System) rappresenta quindi una pratica alternativa, non ionizzante, alle altre opzioni di screening per le donne con tessuto mammario denso. Affiancato alla mammografia, il sistema Invenia ABUS è in grado di migliorare la rilevazione dei tumori invasivi della mammella del 55% rispetto all’utilizzo della sola mammografia.
Perché è necessario eseguire l’ecografia 3D ?
Circa il 40% delle donne ha un tessuto mammario denso. Tale condizione aumenta la percentuale di rischio di sviluppare un tumore di 4-6 volte.4 La mammografia potrebbe non individuare la presenza di un tumore nelle mammelle a tessuto denso. Il sistema Invenia ABUS si è dimostrato in grado di aiutare i medici a rilevare il 55% in più dei tumori invasivi in presenza di risultati mammografici normali o benigni.
Qual’ è la procedura utilizzata per questo esame ?
Il processo di acquisizione del sistema Invenia ABUS utilizza la tecnologia a ultrasuoni 3D per acquisire le immagini del tessuto mammario denso in modo confortevole e rapido. Ogni esame richiede all’incirca 15 minuti.
Diagnosi più efficace – Vista globale per la programmazione:
Il volume 3D e l’accesso multiplanare consentono di analizzare il tumore della mammella in modo accurato e non invasivo grazie alla vista globale della mammella.


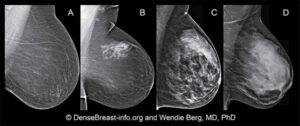
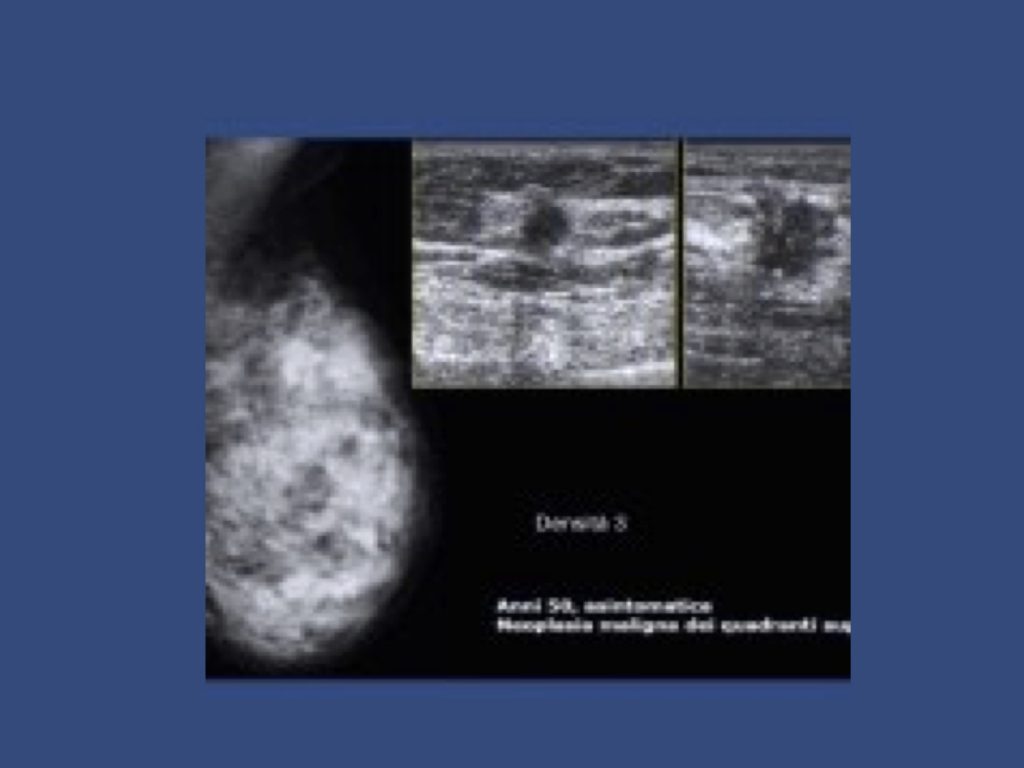
La densità del seno è una misura utilizzata per descrivere la proporzione dei diversi tessuti che compongono il seno di una donna. I seni sono fatti di grasso, tessuto ghiandolare e tessuto connettivo. L’elevata densità del seno significa che esiste una percentuale maggiore di tessuto ghiandolare e connettivo rispetto al grasso. La densità del seno viene misurata con la mammografia. I radiologi classificano la densità mammaria usando una scala di densità a 4 livelli, con il livello 3 che indica seni eterogenei e il livello 4 che indica seni estremamente densi4
(a) prevalentemente adiposo;
(b) a densità fibroghiandolare dispersa;
(c) eterogeneamente denso, tessuto che può impedire la rilevazione di piccole masse; e
(d) tessuto estremamente denso che riduce la sensibilità della mammografia.
La maggiore densità del seno oltre che determinare una riduzione del Valore Predittivo Negativo (VPN) della mammografia, è associata ad un aumentato rischio di sviluppare il cancro al seno. Secondo recenti statistiche, le donne con un seno estremamente denso hanno il doppio del rischio di sviluppare il cancro al seno rispetto alle donne con una densità media del seno. Rispetto alle donne con tessuto adiposo sul seno, le donne con tessuto denso hanno un rischio aumentato da 4 a 6 volte di carcinoma mammario. La densità del seno è un fattore limitante per la rilevazione del carcinoma mammario mediante mammografia poiché il tessuto mammario denso, come i noduli potenzialmente tumorali o benigni, appare opaco sulla mammografia. I limiti della mammografia per la rilevazione del cancro tra le donne con seno denso hanno portato almeno 22 stati degli Stati Uniti a emanare una legislazione che impone ai radiologi di informare i pazienti sulla densità del seno e indicare la possibile necessità di imaging supplementare. Le donne ad alto rischio di carcinoma mammario a causa di mutazioni patogene hanno un alto tasso di “tumori intervallo” rilevati in prevalenza con noduli o altri sintomi nell’intervallo tra mammografia risultata normale e il successivo screening raccomandato. I tumori d’intervallo hanno in genere una prognosi peggiore rispetto ai tumori rilevati dallo screening. I tassi di tumore intervallo aumentano con l’aumentare della densità mammaria e sono elevati nelle donne con una anamnesi personale di carcinoma mammario. In queste donne l’utilizzo associato dell’ecografia alla mammografia permette di incrementare il VPN della sola mammografia e dovrebbe essere routinaria. Le piattaforme automatizzate di ecografia mammaria (ABUS – Automated Breast Ultrasound System; sistema automatizzato di ecografia mammaria) scansionano il seno utilizzando trasduttori a banda larga motorizzati invece delle tradizionali sonde a ultrasuoni a controllo manuale (palmare) per eseguire l’ecografia in modalità B imaging. I sistemi ABUS sono stati sviluppati con lo scopo di essere più veloci nell’acquisizione di immagini standardizzate, e meno dipendenti dalla manualità dell’operatore7 . L’esecuzione dell’esame, al pari della radiologia tradizionale, può essere gestita da personale tecnico sanitario. Alcune piattaforme ABUS incorporano anche un software di rilevamento guidato e consentono l’analisi affiancata o sovrapposta delle immagini ecografiche e mammografiche per facilitarne ulteriormente l’interpretazione. Storicamente, il concetto e la progettazione del primo scanner ultrasonico automatizzato sono iniziati in Australia nel 1965. Gli ultimi dispositivi ABUS tridimensionali sono dotati di un trasduttore ad alta frequenza (7-15 MHz) e una grande sonda lunga 15.3 cm, che consente la ricostruzione di 3 milioni di pixel al secondo con frame rate (frequenze di aggiornamento) molto elevati, in grado di calcolare un volume mammario tridimensionale completo da una singola scansione.8 Sono disponibili due varianti di sistemi ABUS a seconda che prevedano che le pazienti siano posizionate supine (a pancia in su) o in posizione prona (a pancia in giù). I sistemi di acquisizione “da supina” sono costituiti da grandi trasduttori (15 cm) montati su bracci articolati: la paziente viene fatta accomodare su un lettino in posizione supina e il trasduttore viene messo a contatto con il seno. Una volta attivato dal personale Tecnico Sanitario di Radiologia Medica, il trasduttore scannerizza automaticamente il seno ed acquisisce 300 o più immagini 2D egualmente spaziate tra di loro in circa 30 secondi. Isistemi che prevedono la posiziona prona sono costituiti da un trasduttore che viene incassato all’interno di un lettino: le pazienti giacciono prone e il seno è posizionato all’interno dell’incavo del lettino. Il seno viene scansionato in modo radiale mentre il trasduttore ruota di 360 gradi per acquisire una serie di oltre 700 singole immagini 2D che vengono combinate per creare immagini 3D. I sistemi ABUS differiscono dai tradizionali sistemi di imaging ad ultrasuoni esclusivamente nelle sonde che l’operatore muove sul seno della paziente e sui tessuti circostanti per acquisire immagini. Se l’operatore non acquisisce immagini da una o più regioni anatomiche pertinenti, all’interpretazione del medico mancheranno tutti i dati necessari per eseguire una completa interpretazione diagnostica. Pertanto, un esame del seno con ecografia manuale standard completo si basa in gran parte sull’abilità dell’operatore nell’acquisire immagini corrette in tutte le regioni anatomiche necessarie. I sistemi ABUS hanno lo scopo di ridurre i tempi di scansione e facilitare l’interpretazione delle immagini standardizzando i piani di acquisizione, inclusa l’aggiunta di immagini in un piano coronale che corrisponde alla mammografia e che non può essere ottenuto utilizzando la ecografia manuale. Inoltre, alcune piattaforme ABUS incorporano anche un software di rilevamento guidato e consentono l’analisi side-by-side o sovrapposta di immagini ad ultrasuoni e immagini mammografiche per facilitare ulteriormente l’interpretazione9 . L’ecografia automatica ABUS ha poi due ulteriori vantaggi: la possibilità di elaborare immagini secondarie (ovvero calcolate) multi-planari e la capacità di rivedere le immagini in modo retrospettivo una volta acquisito l’esame10. I progressi tecnologici, combinati con la necessità di ridurre la dipendenza dell’ecografia mammaria dall’operatore e la necessità di migliorare i flussi di lavoro, sono i fattori che hanno indirizzato lo sviluppo di sistemi automatizzati di ecografia mammaria. Introduzione di un sistema di ecografia mammaria automatico: impatto clinico, economico e gestionale 14 I sistemi ABUS sono in possesso del Marchio CE e hanno codice CND Z nella Classificazione Nazionale dei Dispositivi medici. Nel 2012 le piattaforme ABUS sono state approvate dalla Food and Drug Administration degli Stati Uniti come tecnica aggiuntiva di screening del seno intero nelle donne con seno denso e con risultati negativi alla mammografia11. Descrizione del progetto Diversamente dalla ecografia manuale, il sistema ABUS può essere gestito da personale non medico dopo specifica istruzione e addestramento. La scansione può essere elaborata automaticamente con l’intero seno coperto da un ampio trasduttore. Pertanto, vengono eliminate le limitazioni dipendenti dall’operatore e la non standardizzazione della procedura5 . Verranno analizzati gli aspetti clinici, economici e gestionali di ABUS per determinare la fattibilità di un suo uso routinario nella UOC da me diretta. Sono comunque da tenere presenti le principali limitazioni dei sistemi ABUS che sono l’esclusione delle regioni ascellari dal campo visivo e l’assenza di strumenti integrati per gli esami Doppler e per le funzioni elastografiche, che costituiscono metodiche importanti per la valutazione della neoplasia mammaria14 tramite l’esame della vascolarizzazione e della elasticità dei tessuti5 . Impatto clinico Un ampio studio osservazionale nel “mondo reale” (ovvero in condizioni non strettamente controllate come accade negli studi clinici tradizionali) negli USA su donne con seno denso che si sono presentate consecutivamente per la mammografia di screening di routine ha dimostrato una migliore rilevazione del carcinoma mammario mammograficamente occulto utilizzando ABUS rispetto al solo screening mammografico12. Un rapporto dell’istituto statunitense ECRI7 nel luglio 2019 ha esaminato la documentazione scientifica comparativa esistente per la ecografia automatizzata della mammella ABUS, alla ricerca di informazioni verificabili concernenti due variabili importanti nella definizione del valore di qualsiasi tecnologia sanitaria di tipo diagnostico: la validità clinica e la utilità clinica. 1. La validità clinica, anche denominata accuratezza diagnostica, si riferisce all’accuratezza con cui un test o una procedura diagnostica prevede la presenza o l’assenza di una determinata condizione clinica o predisposizione. La validità clinica è descritta in termini di sensibilità e specificità, che sono proprietà tecniche assolute (ovvero invarianti tra popolazioni differenti) della tecnologia, e di valori predittivi positivi e negativi, che sono altre proprietà tecniche della tecnologia ma che dipendono anche dal tipo di pazienti esplorati in studi diagnostici di coorte. Tali studi in genere confrontano una modalità diagnostica con un’altra eseguendo entrambe le procedure diagnostiche nei medesimi pazienti e con procedure di controllo dei possibili fattori confondenti. Generalmente gli studi di validità clinica con meno di 100 pazienti esaminati hanno un potere statistico insufficiente per fornire dati clinicamente significativi, ovvero credibili per decisioni cliniche concrete. 2. L’utilità clinica si riferisce invece all’impatto del test sugli esiti di salute dei pazienti quando si confronta l’uso dei risultati di una modalità diagnostica con un’altra. L’utilità clinica rappresenta un equilibrio tra benefici per la salute e potenziali svantaggi (danni) che possono derivare dall’uso dei risultati dei test per guidare la Introduzione di un sistema di ecografia mammaria automatico: impatto clinico, economico e gestionale gestione ed il trattamento dei pazienti. La prevalenza della malattia nella popolazione target e la probabilità a priori del test (parametri esaminati con approcci bayesiani) hanno un profondo impatto sulla validità clinica e differiscono in modo significativo nei pazientisottoposti a imaging per finalità differenti, ovvero per lo screening del cancro, o per la precisazione diagnostica, o per la stadiazione della malattia nota o infine per il follow-up della paziente trattata. Allo stesso modo, le decisioni terapeutiche e gli esiti disalute correlati al cancro non sono comparabili tra queste popolazioni. Ad esempio, i rischi di disagio e di eventi avversi possono differire negli studi che esplorano contesti e finalità cliniche differenti. Pertanto, nel rapporto ECRIsono stati presi in considerazione solo studi su donne non trattate sottoposte a ABUS per la diagnosi di tumori al seno sospetti (cioè con segni o sintomi di cancro al seno o risultati anormali da screening mammografico) per determinare il grado di validità clinica e di utilità clinica della metodica, in confronto con lo standard che in genere è l’esame mammografico di routine. Nel rapporto ECRI 2019, riguardo alla validità clinica e alla utilità clinica di ABUS nelle donne con segni o sintomi di carcinoma mammario o mammografia di screening anomala, tra la gran massa di documentazioni indicizzate sono state selezionati, ed esaminati in testo completo, solo le revisioni sistematiche (RS), gli studi di coorte diagnostici se eseguiti su oltre 1.000 pazienti e gli studi comparativi di utilità clinica eseguiti su almeno 10 pazienti. Sono pertanto stati esaminati 5 articoli in testo completo e 2 in solo formato abstract che riportavano su un totale di 47.334 pazienti: • 1 RS (su 13 studi, n pazienti = 1.664) ha riportato l’accuratezza diagnostica di ABUS usando la biopsia come test di riferimento. • 1 RS (9 studi, n = 1.774) ha confrontato ABUS ed ecografia manuale e riportato l’accuratezza diagnostica usando la biopsia come test di riferimento. • 1 RS (39 studi, n = 41.672) ha confrontato ABUS con altre modalità di imaging (mammografia, elastografia, scintigrafia, risonanza magnetica nucleare, tomografia ad emissione di positroni / tomografia computerizzata [PET / CT]) e riportato l’accuratezza diagnostica usando la biopsia come test di riferimento. • 1 studio prospettico di coorte diagnostico (n = 1.973) ha confrontato ABUS e ed ecografia manuale in pazienti con sospetto carcinoma mammario e riportato l’accuratezza diagnostica mediante biopsia oppure risonanza magnetica nucleare come test di riferimento. • 1 studio di coorte diagnostico retrospettivo (n = 1.000) ha riportato l’accuratezza diagnostica di ABUS senza confronto con ecografia manuale e avendo la biopsia o il follow-up di 2 anni come gold standard per stabilire la diagnosi finale. Le meta-analisi riportate nelle RS e gli studi diagnostici di coorte con appropriati campioni e test di riferimento forniscono un’adeguata evidenza della validità clinica dell’ABUS. Tuttavia, nessuno studio comparativo riporta gli esiti procedurali,sia di natura clinica che economica (ad es. il tempo di procedura, la fattibilità tecnica, il rapporto costo-efficacia) dell’uso di ABUS in pazienti con sospetto carcinoma mammario7 . La valutazione critica dell’efficacia di ABUS nel contesto dello screening supplementare richiederebbe la realizzazione distudi clinici controllati e randomizzati per valutarne il beneficio nelridurre i tassi di mortalità. Tali studi randomizzati non sono stati eseguiti, neppure per valutare l’efficacia della ecografia manuale quale metodica supplementare nello screening14, e richiederebbero un periodo di follow-up a lungo termine superiore a 10 anni oltre a risorse considerevoli, e le tecnologie esaminate sarebbero nel frattempo cambiate in modo tale che i risultati risulterebbero obsoleti. Pertanto, le indicazioni sull’efficacia di ABUS e più precisamente sull’impatto di tale metodica automatizzata nella riduzione del tasso di mortalità è solo suggerita dai risultati riportati per misure di esito surrogato, quali la dimensione del tumore, la percentuale di tumori invasivi, il grado e lo stato dei linfonodi, nonché i tassi di “tumore intervallo”8 . Uno studio monocentrico presso un ospedale svedese ad alto volume di casi trattati, disegnato per esplorare l’utilità clinica di uno screening supplementare con ABUS in aggiunta alla mammografia standard (e non quindi Introduzione di un sistema di ecografia mammaria automatico: impatto clinico, economico e gestionale 16 la performance diagnostica comparativa con ecografia manuale o mammografia) ha evidenziato che la possibilità di aumentare il tasso di riscontro tumorale nelle donne tra 40 e 74 anni grazie all’impiego di ABUS, mantenendo allo stesso tempo un tasso di richiamo per controlli aggiuntivi sufficientemente basso, nell’ambito dei livelli raccomandati dalle linee guida europee in materia, è fattibile in un centro specialistico di screening ad alto volume15. Non è noto se analoghi risultati potrebbero essere assicurati dalla implementazione di ABUS in centri con volumi di attività medio-piccole. Riguardo alla validità clinica di ABUS, una meta-analisi di studi diagnostici di coorte (13 studi, n = 1.664) e un altro ampio studio (n = 1.973) hanno riportato una sensibilità tra il 91% al 94% e una specificità dall’88% al 90% per la rilevazione del carcinoma mammario con ABUS utilizzando la biopsia o il follow-up clinico a 2 anni come gold standard di riferimento. 1 altro studio diagnostico di coorte (n = 1.000) ha riportato una precisione da bassa a moderata (area sotto la curva della caratteristica operativa di ricezione da 0,70 a 0,86) per la accuratezza diagnostica complessiva7. Una meta-analisi (su 9 studi, n = 1.774) non ha riscontrato differenze di precisione tra ABUS e ecografia manuale utilizzando la biopsia come standard di riferimento per la diagnosi 13. Le meta-analisi pubblicate di studi di coorte diagnostici mostrano che la metodica ABUS è accurata come la ecografia mammaria manuale per rilevare il carcinoma mammario nelle donne con segni o sintomi di carcinoma mammario o anomalie osservate in una mammografia di screening7 . Vari studi hanno valutato le prestazioni dei sistemi ABUS nella rilevazione del cancro mammario, quando applicato in aggiunta alla mammografia nelle donne con seno denso. I risultati di un ampio studio multicentrico prospettico che ha valutato 15.318 donne hanno dimostrato che la ABUS era associata a un tasso di rilevazione del cancro incrementale (ICDR) di 30 tumori complessivi (ovvero 1,9 neoplasie in più ogni 1.000 donne sottoposte a screening) e che i tumori rilevati erano carcinomi invasivi piccoli con linfonodi negativi, ovvero identificati in fase clinica relativamente precoce8 . Miglioramento di esiti riferiti o risultati percepiti dai pazienti Riguardo alla qualità percepita dal paziente, in termini di gradimento complessivo e tolleranza alla compressione della mammella durante l’esame, con uno studio monocentrico condotto in un ospedale universitario in Germania è stato richiesto a 868 pazienti di valutare la propria percezione degli esami condotti con SomoV ™, un sistema ABUS commercializzato dalla ditta U-Systems, San Jose, CA USA, poi acquisita da GE nel 2012. I pazienti si sono espressi su una scala da 1 a 10 immediatamente dopo il completamento dell’esame ABUS con tale sistema. Il voto medio per la domanda concernente il comfort del paziente è stato di 2.3 (deviazione standard – DS 1.7, su una scala da 0 a 10 con gradimento migliore nei punteggi bassi; Figura 9). Per la percezione della compressione del seno durante l’esame, la media era di 3,1 (DS 2,1 con analoga scala). Entrambi i valori suggeriscono una percezione piuttosto confortevole con una compressione tollerabile delseno durante l’esame, indipendentemente dall’indicazione per l’esame16. Introduzione di un sistema di ecografia mammaria automatico: impatto clinico, economico e gestionale Figura 1: tratta da Maier et al162017
Per essere classificata come maligna, una formazione nodulare deve presentare una delle seguenti caratteristiche:
- Contorno spiculato
- Orientamento non parallelo
- Margine angolare
- Ipoecogenicità marcata
- Ombra acustica posteriore
- Calcificazioni puntiformi
- Estensione Duttale
- Modello Branch
- Microlobulazioni
 L’Ecografia nella pratica clinica
L’Ecografia nella pratica clinica
Le attuali indicazioni per il seno degli US, come raccomandato dalla American College of Practice Guidelines Radiologia includono la valutazione di anomalie palpabili o altri sintomi del seno, l’integrazione nei casi di mammografie o RM- che hanno rilevato anomalie, e la valutazione delle protesi del seno ( 57 ). Inoltre, viene utilizzata di routine come guida durante le procedure interventistiche, la pianificazione del trattamento per la radioterapia, lo screening in alcuni gruppi di donne, e la valutazione dei linfonodi ascellari. In letteratura molto è stato scritto su questi usi e un dibattito globale è oltre la portata di questo articolo. Alcuni temi importanti e attuali, tuttavia, saranno rivisti.
La valutazione dei risultati mammografici
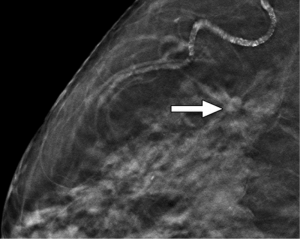
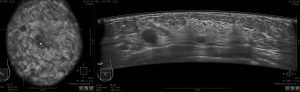
L’ecografia mirata e complementare alla mammografia grazie alla sua capacità di differenziare le lesioni cistiche da quelle solide è anche utile nello studio delle asimmetrie e nei seni densi, in quanto può aiutare a identificare o escludere la presenza di una massa sottostante. Lesioni veramente ipoecogene possono spesso essere differenziate da lobuli di grasso attraverso la scansione su piani multipli, poiché le vere lesioni di solito non si fondono o si allungano in tessuti adiacenti. Con l’introduzione della tomosintesi digitale del seno nell’imaging mammografico, gli ultrasuoni giocheranno ancora un ruolo importante. Come le lesioni mammografiche possono spesso essere individuate, localizzate e avere un’adeguata valutazione del margine sulle immagini in 3D, le pazienti con lesioni rilevate alla tomosintesi possono spesso essere valutate direttamente dall’ecografia, evitando ulteriore imaging mammografico con i relativi costi e l’esposizione alle radiazioni ( Fig. 10).
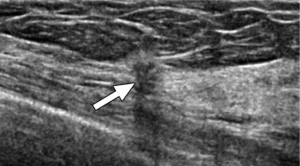
Figura 10a:(a) Screening mammografico cranio-caudale tomosintesi in una donna di 75 anni, raffigura un piccolo nodulo spiculato (freccia).
Figura 10b: (b)La paziente è stata sottoposta ad ecografia mirata che ha confermato la presenza di una piccola massa irregolare sospetta ipoecogena con diametro maggiore trasversale (più alto-che-largo) con margini indistinti e ombra acustica posteriore (freccia). .

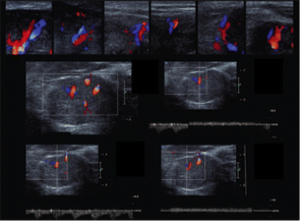
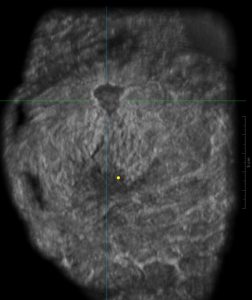
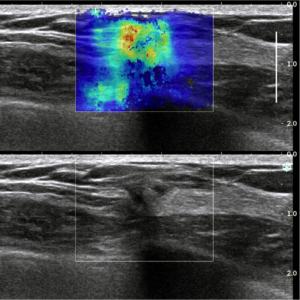 Figura 10c: (c) Le immagini ottenute con 3D US combinate con elastografia dimostrano una massa irregolare con rigidità moderata, come fa notare la sovrapposizione di colore verde e giallo . Lesione, orientamento in senso orario da in alto a sinistra: sagittale, trasversale, 3D e coronale CNB planes.Agobiopsia guidata ha dimostrato un carcinoma duttale infiltrante.
Figura 10c: (c) Le immagini ottenute con 3D US combinate con elastografia dimostrano una massa irregolare con rigidità moderata, come fa notare la sovrapposizione di colore verde e giallo . Lesione, orientamento in senso orario da in alto a sinistra: sagittale, trasversale, 3D e coronale CNB planes.Agobiopsia guidata ha dimostrato un carcinoma duttale infiltrante.
L’uso di una supplementare ecografia mammaria, eseguita in aggiunta alla mammografia, rimane controversa nonostante la capacità di rilevare piccoli tumori mammograficamente occulti. US ha un valore limitato per la rilevazione di piccole microcalcificazioni raggruppate senza una lesione mammaria associata. Valori predittivi positivi bassi con meno del 12% su biopsie effettuate sono state costantemente riportati ( 77 , 87 ). Nessun studio di outcome è stato in grado di dimostrare una riduzione diretta della mortalità dei pazienti a causa del rilevamento di questi ulteriori tumori piccoli e occulti alla mammografia. Ciò richiederebbe un lungo studio randomizzato, che non è fattibile. Razionalmente, però, la diagnosi precoce e il trattamento di altri tumori di piccole dimensioni dovrebbero migliorare i risultati e ridurre la morbilità e la mortalità complessiva. Molte compagnie di assicurazione americane non rimborsano per lo screening del tumore al seno, questo esame non è stata ampiamente accettata negli Stati Uniti.
Ciononostante, a causa sia della efficacia nota e una maggiore consapevolezza generale del cancro al seno, più donne e medici stanno richiedendo questo esame. In effetti, in alcuni paesi i radiologi informano le donne sui problemi derivanti dalla densità del seno e consigliano loro di discutere di screening supplementare con i loro medici. Anche se supplementare la RM mammaria è in genere preferita per le donne che sono ad alto rischio per il cancro al seno (per esempio, le donne con un rischio di vita di oltre il 20%, ad esempio, quelle donne che sono BRCA positive o presentano famigliari di primo grado con un storia di cancro al seno in premenopausa), lo screening della mammella con ecografia dovrebbe essere considerato nelle donne ad alto rischio per il cancro al seno che non tollerano RM mammaria, così come le donne con tessuto mammario denso e rischio intermedio (ad esempio, rischio di vita del 15% – 20%, per esempio quelle donne il cui l’unico fattore di rischio è una storia personale di cancro al seno o precedente biopsia di una lesione ad alto rischio). Futuri studi sono necessari per stabilire le strategie per ridurre i falsi positivi e continuare a ottimizzare lo screening ecografico ed automatizzato in donne con tessuto mammario mammograficamente denso .

Stadiazione preoperatoria del cancro con ecografia
RM mammaria ha dimostrato di essere più sensibile dell’ecografia nella rilevazione di focolai di malattia aggiuntivi occulti alla mammografia nelle donne con cancro al seno ( 97 – 99 ). Tuttavia, quando una massa altamente sospetta viene identificata in mammografia e US, US immediata valutazione del resto della mammella ipsilaterale, la mammella controlaterale, e l’ascella deve sempre effettuata. Se le lesioni supplementari sono identificate, stadiazione preoperatoria con la RM può essere evitata e la biopsia ecoguidata può essere effettuata tempestivamente, risparmiando il tempo prezioso del paziente e la spesa ( 100 ). In uno studio condotto da Moon et al ( 101 ), di 201 pazienti con cancro al seno di nuova diagnosi, stadiazione statunitense ha dimostrato un occulto alla mammografia malattia multifocale o multicentrico in 28 pazienti (14%) e della mammella controlaterale in otto pazienti (4%), con conseguente una modifica della terapia in 32 pazienti (16%).
L’ecografia può anche essere utilizzato per identificare la stazione ascellare , sopraclaveare, e i linfonodi mammari interni. Linfonodi anormali tipicamente dimostrano ispessimento focale o diffuso della corticale (≥ 3 mm di spessore),forma rotonda (piuttosto che ovale o reniforme) , la perdita del grasso, ilo iperecogeno e / o,, vasi sanguigni irregolari , disorganizzati ( 102 , 103 ) ( Fig. 14). Un ecoguidata CNB o con ago sottile aspirazione positiva di un linfonodo ascellare clinicamente anormale in un paziente con un tumore al seno conosciuto può aiutare la gestione del paziente, evitando la necessità di una biopsia del linfonodo sentinella e consentendo al paziente, invece di procedere direttamente alla linfonodi ascellari dissezione di nodo o chemioterapia neoadiuvante.
I progressi tecnici negli ultrasuoni permettono la diagnosi completa , la gestione e il trattamento delle lesioni mammarie.L’utilizzo ottimale della tecnologia, la tecnica meticolosa della scansione con particolare attenzione alla morfologia della lesione, il riconoscimento e la sintesi dei risultati di molteplici modalità di imaging sono essenziali per la gestione ottimale della paziente. In futuro, l’utilizzo degli ultrasuoni avrà una portata sempre maggiore di indicazioni anche nello screening,se personalizzato.Applicando strumenti di recente sviluppo, il valore dell’ecografia probabilmente continuerà a crescere ed evolvere.
| •L’ecografia dipende dall’operatore; la conoscenza e la valutazione delle diverse opzioni tecniche attualmente disponibili sono importanti per l’ottimizzazione delle immagini e una diagnosi accurata. | |
| •L’ecografia è una, modalità dinamica interattiva e di scansione in tempo reale. E’ necessario valutare i risultati associati a malignità. | |
| •La capacità di sintetizzare le informazioni ottenute dall’esame ecografico confrontato con la mammografia , la RM, e l’esame clinico del seno è fondamentale per una diagnosi accurata. | |
| • L’uso dell’ecografia associato alla mammografia, soprattutto nelle donne con tessuto mammario denso, sta diventando sempre più ampiamente diffuso accettato. | |
| • L’esame bioptico ecoguidato è il metodo principale utilizzato nella maggior parte delle pratiche di imaging del seno, e il radiosenologo deve avere familiarità con i vari dispositivi di biopsia e le tecniche per tipizzare adeguatamente qualsiasi lesione individuata agli US. |
Bibliografia
| 1. | Dempsey PJ. The history of breast ultrasound. J Ultrasound Med 2004;23(7):887–894. [Medline] |
| 2. | Stavros AT, Thickman D, Rapp CL, Dennis MA, Parker SH, Sisney GA. Solid breast nodules: use of sonography to distinguish between benign and malignant lesions. Radiology 1995;196(1):123–134. [Abstract] [Medline] |
| 3. | Mainiero MB, Goldkamp A, Lazarus E, et al.. Characterization of breast masses with sonography: can biopsy of some solid masses be deferred? J Ultrasound Med 2005;24(2):161–167. [Medline] |
| 4. | Graf O, Helbich TH, Hopf G, Graf C, Sickles EA. Probably benign breast masses at US: is follow-up an acceptable alternative to biopsy?Radiology 2007;244(1):87–93. [Abstract] [Medline] |
| 5. | Mendelson EB, Baum JK, Berg WA, Merritt CR, Rubin E. Breast Imaging Reporting Data System. BI-RADS: Ultrasound. Reston, Va:American College of Radiology, 2003. |
| 6. | Berg WA, Blume JD, Cormack JB, Mendelson EB. Training the ACRIN 6666 Investigators and effects of feedback on breast ultrasound interpretive performance and agreement in BI-RADS ultrasound feature analysis. AJR Am J Roentgenol 2012;199(1):224–235.[CrossRef] [Medline] |
| 7. | Stafford RJ, Whitman GJ. Ultrasound physics and technology in breast imaging. Ultrasound Clin 2011;6(3):299–312. [CrossRef] |
| 8. | Weinstein SP, Conant EF, Sehgal C. Technical advances in breast ultrasound imaging. Semin Ultrasound CT MR 2006;27(4):273–283.[CrossRef] [Medline] |
| 9. | Athanasiou A, Tardivon A, Ollivier L, Thibault F, El Khoury C, Neuenschwander S. How to optimize breast ultrasound. Eur J Radiol2009;69(1):6–13. [CrossRef] [Medline] |
| 10. | Kremkau FW. Sonography principles and instruments. 8th ed. St Louis, Mo: Elsevier-Saunders, 2011. |
| 11. | Goss SA, Johnston RL, Dunn F. Comprehensive compilation of empirical ultrasonic properties of mammalian tissues. J Acoust Soc Am1978;64(2):423–457. [CrossRef] [Medline] |
| 12. | Napolitano D, Chou CH, McLaughlin G, et al.. Sound speed correction in ultrasound imaging. Ultrasonics 2006;44(Suppl 1):e43–e46.[CrossRef] [Medline] |
| 13. | Barr RG, Rim A, Graham R, Berg W, Grajo JR. Speed of sound imaging: improved image quality in breast sonography. Ultrasound Q2009;25(3):141–144. [CrossRef] [Medline] |
| 14. | Stavros AT. Breast ultrasound. Philadelphia, Pa: Lippincott, Williams & Wilkins, 2004. |
| 15. | Cosgrove DO, Kedar RP, Bamber JC, et al.. Breast diseases: color Doppler US in differential diagnosis. Radiology 1993;189(1):99–104.[Abstract] [Medline] |
| 16. | Sehgal CM, Arger PH, Rowling SE, Conant EF, Reynolds C, Patton JA. Quantitative vascularity of breast masses by Doppler imaging: regional variations and diagnostic implications. J Ultrasound Med 2000;19(7):427–440; quiz 441–442. [Medline] |
| 17. | Birdwell RL, Ikeda DM, Jeffrey SS, Jeffrey RB. Preliminary experience with power Doppler imaging of solid breast masses. AJR Am J Roentgenol 1997;169(3):703–707. [CrossRef] [Medline] |
| 18. | Gokalp G, Topal U, Kizilkaya E. Power Doppler sonography: anything to add to BI-RADS US in solid breast masses? Eur J Radiol2009;70(1):77–85. [CrossRef] [Medline] |
| 19. | Tozaki M, Fukuma E. Does power Doppler ultrasonography improve the BI-RADS category assessment and diagnostic accuracy of solid breast lesions? Acta Radiol 2011;52(7):706–710. [CrossRef] [Medline] |
| 20. | Mehta TS, Raza S, Baum JK. Use of Doppler ultrasound in the evaluation of breast carcinoma. Semin Ultrasound CT MR2000;21(4):297–307. [CrossRef] [Medline] |
| 21. | Horvath E, Silva C, Fasce G, et al.. Parallel artery and vein: sign of benign nature of breast masses. AJR Am J Roentgenol2012;198(1):W76–W82. [CrossRef] [Medline] |
| 22. | Campbell SC, Cullinan JA, Rubens DJ. Slow flow or no flow? Color and power Doppler US pitfalls in the abdomen and pelvis.RadioGraphics 2004;24(2):497–506. [Abstract] [Medline] |
| 23. | Schaefer FK, Heer I, Schaefer PJ, et al.. Breast ultrasound elastography: results of 193 breast lesions in a prospective study with histopathologic correlation. Eur J Radiol 2011;77(3):450–456. [CrossRef] [Medline] |
| 24. | Zhao QL, Ruan LT, Zhang H, Yin YM, Duan SX. Diagnosis of solid breast lesions by elastography 5-point score and strain ratio method.Eur J Radiol 2012;81(11):3245–3249. [CrossRef] [Medline] |
| 25. | Stachs A, Hartmann S, Stubert J, et al.. Differentiating between malignant and benign breast masses: factors limiting sonoelastographic strain ratio. Ultraschall Med 2013;34(2):131–136. [Medline] |
| 26. | Bercoff J, Tanter M, Fink M. Supersonic shear imaging: a new technique for soft tissue elasticity mapping. IEEE Trans Ultrason Ferroelectr Freq Control 2004;51(4):396–409. [CrossRef] [Medline] |
| 27. | Itoh A, Ueno E, Tohno E, et al.. Breast disease: clinical application of US elastography for diagnosis. Radiology 2006;239(2):341–350.[Abstract] [Medline] |
| 28. | Berg WA, Cosgrove DO, Doré CJ, et al.. Shear-wave elastography improves the specificity of breast US: the BE1 multinational study of 939 masses. Radiology 2012;262(2):435–449. [Abstract] [Medline] |
| 29. | Athanasiou A, Tardivon A, Tanter M, et al.. Breast lesions: quantitative elastography with supersonic shear imaging—preliminary results.Radiology 2010;256(1):297–303. [Abstract] [Medline] |
| 30. | Evans A, Whelehan P, Thomson K, et al.. Invasive breast cancer: relationship between shear-wave elastographic findings and histologic prognostic factors. Radiology 2012;263(3):673–677. [Abstract] [Medline] |
| 31. | Fleury Ede F, Fleury JC, Piato S, Roveda D. New elastographic classification of breast lesions during and after compression. Diagn Interv Radiol 2009;15(2):96–103. [Medline] |
| 32. | Tozaki M, Fukuma E. Pattern classification of ShearWave™ Elastography images for differential diagnosis between benign and malignant solid breast masses. Acta Radiol 2011;52(10):1069–1075. [CrossRef] [Medline] |
| 33. | Barr RG, Lackey AE. The utility of the “bull’s-eye” artifact on breast elasticity imaging in reducing breast lesion biopsy rate. Ultrasound Q2011;27(3):151–155. [CrossRef] [Medline] |
| 34. | Cosgrove DO, Berg WA, Doré CJ, et al.. Shear wave elastography for breast masses is highly reproducible. Eur Radiol2012;22(5):1023–1032. [CrossRef] [Medline] |
| 35. | Kalmantis K, Dimitrakakis C, Koumpis C, et al.. The contribution of three-dimensional power Doppler imaging in the preoperative assessment of breast tumors: a preliminary report. Obstet Gynecol Int 2009;2009:530579. |
| 36. | Chadha M, Young A, Geraghty C, Masino R, Harrison L. Image guidance using 3D-ultrasound (3D-US) for daily positioning of lumpectomy cavity for boost irradiation. Radiat Oncol 2011;6:45. [CrossRef] [Medline] |
| 37. | Hilton SV, Leopold GR, Olson LK, Willson SA. Real-time breast sonography: application in 300 consecutive patients. AJR Am J Roentgenol 1986;147(3):479–486. [CrossRef] [Medline] |
| 38. | Berg WA, Sechtin AG, Marques H, Zhang Z. Cystic breast masses and the ACRIN 6666 experience. Radiol Clin North Am2010;48(5):931–987. [CrossRef] [Medline] |
| 39. | Kolb TM, Lichy J, Newhouse JH. Occult cancer in women with dense breasts: detection with screening US—diagnostic yield and tumor characteristics. Radiology 1998;207(1):191–199. [Abstract] [Medline] |
| 40. | Buchberger W, DeKoekkoek-Doll P, Springer P, Obrist P, Dünser M. Incidental findings on sonography of the breast: clinical significance and diagnostic workup. AJR Am J Roentgenol 1999;173(4):921–927. [CrossRef] [Medline] |
| 41. | Berg WA, Campassi CI, Ioffe OB. Cystic lesions of the breast: sonographic-pathologic correlation. Radiology 2003;227(1):183–191.[Abstract] [Medline] |
| 42. | Chang YW, Kwon KH, Goo DE, Choi DL, Lee HK, Yang SB. Sonographic differentiation of benign and malignant cystic lesions of the breast. J Ultrasound Med 2007;26(1):47–53. [Medline] |
| 43. | Daly CP, Bailey JE, Klein KA, Helvie MA. Complicated breast cysts on sonography: is aspiration necessary to exclude malignancy?Acad Radiol 2008;15(5):610–617. [CrossRef] [Medline] |
| 44. | Venta LA, Kim JP, Pelloski CE, Morrow M. Management of complex breast cysts. AJR Am J Roentgenol 1999;173(5):1331–1336.[CrossRef] [Medline] |
| 45. | Hong AS, Rosen EL, Soo MS, Baker JA. BI-RADS for sonography: positive and negative predictive values of sonographic features. AJR Am J Roentgenol 2005;184(4):1260–1265. [CrossRef] [Medline] |
| 46. | Raza S, Chikarmane SA, Neilsen SS, Zorn LM, Birdwell RL. BI-RADS 3, 4, and 5 lesions: value of US in management—follow-up and outcome. Radiology 2008;248(3):773–781. [Abstract] [Medline] |
| 47. | Harvey JA, Nicholson BT, Lorusso AP, Cohen MA, Bovbjerg VE. Short-term follow-up of palpable breast lesions with benign imaging features: evaluation of 375 lesions in 320 women. AJR Am J Roentgenol 2009;193(6):1723–1730. [CrossRef] [Medline] |
| 48. | Graf O, Helbich TH, Fuchsjaeger MH, et al.. Follow-up of palpable circumscribed noncalcified solid breast masses at mammography and US: can biopsy be averted? Radiology 2004;233(3):850–856. [Abstract] [Medline] |
| 49. | Linda A, Zuiani C, Lorenzon M, et al.. Hyperechoic lesions of the breast: not always benign. AJR Am J Roentgenol2011;196(5):1219–1224. [CrossRef] [Medline] |
| 50. | Soon PS, Vallentine J, Palmer A, Magarey CJ, Schwartz P, Morris DL. Echogenicity of breast cancer: is it of prognostic value? Breast2004;13(3):194–199. [CrossRef] [Medline] |
| 51. | Moon WK, Myung JS, Lee YJ, Park IA, Noh DY, Im JG. US of ductal carcinoma in situ. RadioGraphics 2002;22(2):269–280; discussion 280–281. [Abstract] [Medline] |
| 52. | Yang WT, Tse GM. Sonographic, mammographic, and histopathologic correlation of symptomatic ductal carcinoma in situ. AJR Am J Roentgenol 2004;182(1):101–110. [CrossRef] [Medline] |
| 53. | Izumori A, Takebe K, Sato A. Ultrasound findings and histological features of ductal carcinoma in situ detected by ultrasound examination alone. Breast Cancer 2010;17(2):136–141. [CrossRef] [Medline] |
| 54. | Park JS, Park YM, Kim EK, et al.. Sonographic findings of high-grade and non-high-grade ductal carcinoma in situ of the breast. J Ultrasound Med 2010;29(12):1687–1697. [Medline] |
| 55. | Moon WK, Im JG, Koh YH, Noh DY, Park IA. US of mammographically detected clustered microcalcifications. Radiology2000;217(3):849–854. [Abstract] [Medline] |
| 56. | Soo MS, Baker JA, Rosen EL. Sonographic detection and sonographically guided biopsy of breast microcalcifications. AJR Am J Roentgenol 2003;180(4):941–948. [CrossRef] [Medline] |
| 57. | ACR Practice Guideline for the Performance of a Breast Ultrasound Examination. American College of Radiology.http://www.acr.org/Quality-Safety/Standards-Guidelines./Practice-Guidelines-by-Modality/Ultrasound. Published 2011. |
| 58. | Abdullah N, Mesurolle B, El-Khoury M, Kao E. Breast imaging reporting and data system lexicon for US: interobserver agreement for assessment of breast masses. Radiology 2009;252(3):665–672. [Abstract] [Medline] |
| 59. | Heinig J, Witteler R, Schmitz R, Kiesel L, Steinhard J. Accuracy of classification of breast ultrasound findings based on criteria used for BI-RADS. Ultrasound Obstet Gynecol 2008;32(4):573–578. [CrossRef] [Medline] |
| 60. | Mansel R. Management of breast pain. In: , Harris JR, Lippman ME, Morrow M, Osborne CK, eds. Diseases of the breast. 4th ed.Philadelphia, Pa: Lippincott Williams & Wilkins, 2010; 52. |
| 61. | Leung JW, Kornguth PJ, Gotway MB. Utility of targeted sonography in the evaluation of focal breast pain. J Ultrasound Med2002;21(5):521–526; quiz 528–529. [Medline] |
| 62. | Loving VA, DeMartini WB, Eby PR, Gutierrez RL, Peacock S, Lehman CD. Targeted ultrasound in women younger than 30 years with focal breast signs or symptoms: outcomes analyses and management implications. AJR Am J Roentgenol 2010;195(6):1472–1477.[CrossRef] [Medline] |
| 63. | Soo MS, Rosen EL, Baker JA, Vo TT, Boyd BA. Negative predictive value of sonography with mammography in patients with palpable breast lesions. AJR Am J Roentgenol 2001;177(5):1167–1170. [CrossRef] [Medline] |
| 64. | Tumyan L, Hoyt AC, Bassett LW. Negative predictive value of sonography and mammography in patients with focal breast pain. Breast J2005;11(5):333–337. [CrossRef] [Medline] |
| 65. | Lehman CD, Lee CI, Loving VA, Portillo MS, Peacock S, DeMartini WB. Accuracy and value of breast ultrasound for primary imaging evaluation of symptomatic women 30-39 years of age. AJR Am J Roentgenol 2012;199(5):1169–1177. [CrossRef] [Medline] |
| 66. | Ballesio L, Maggi C, Savelli S, et al.. Role of breast magnetic resonance imaging (MRI) in patients with unilateral nipple discharge: preliminary study. Radiol Med (Torino) 2008;113(2):249–264. [CrossRef] |
| 67. | Sabel MS, Helvie MA, Breslin T, et al.. Is duct excision still necessary for all cases of suspicious nipple discharge? Breast J2012;18(2):157–162. [CrossRef] [Medline] |
| 68. | Morrogh M, Morris EA, Liberman L, Borgen PI, King TA. The predictive value of ductography and magnetic resonance imaging in the management of nipple discharge. Ann Surg Oncol 2007;14(12):3369–3377. [CrossRef] [Medline] |
| 69. | Robbins J, Jeffries D, Roubidoux M, Helvie M. Accuracy of diagnostic mammography and breast ultrasound during pregnancy and lactation. AJR Am J Roentgenol 2011;196(3):716–722. [CrossRef] [Medline] |
| 70. | Liberman L, Giess CS, Dershaw DD, Deutch BM, Petrek JA. Imaging of pregnancy-associated breast cancer. Radiology1994;191(1):245–248. [Abstract] [Medline] |
| 71. | Ahn BY, Kim HH, Moon WK, et al.. Pregnancy- and lactation-associated breast cancer: mammographic and sonographic findings. J Ultrasound Med 2003;22(5):491–497; quiz 498–499. [Medline] |
| 72. | Kolb TM, Lichy J, Newhouse JH. Comparison of the performance of screening mammography, physical examination, and breast US and evaluation of factors that influence them: an analysis of 27,825 patient evaluations. Radiology 2002;225(1):165–175. [Abstract] [Medline] |
| 73. | Buchberger W, Niehoff A, Obrist P, DeKoekkoek-Doll P, Dünser M. Clinically and mammographically occult breast lesions: detection and classification with high-resolution sonography. Semin Ultrasound CT MR 2000;21(4):325–336. [CrossRef] [Medline] |
| 74. | Crystal P, Strano SD, Shcharynski S, Koretz MJ. Using sonography to screen women with mammographically dense breasts. AJR Am J Roentgenol 2003;181(1):177–182. [CrossRef] [Medline] |
| 75. | Gordon PB, Goldenberg SL. Malignant breast masses detected only by ultrasound: a retrospective review. Cancer 1995;76(4):626–630.[CrossRef] [Medline] |
| 76. | Kaplan SS. Clinical utility of bilateral whole-breast US in the evaluation of women with dense breast tissue. Radiology2001;221(3):641–649. [Abstract] [Medline] |
| 77. | Berg WA, Blume JD, Cormack JB, et al.. Combined screening with ultrasound and mammography vs mammography alone in women at elevated risk of breast cancer. JAMA 2008;299(18):2151–2163. [CrossRef] [Medline] |
| 78. | Hooley RJ, Greenberg KL, Stackhouse RM, Geisel JL, Butler RS, Philpotts LE. Screening US in patients with mammographically dense breasts: initial experience with Connecticut Public Act 09-41. Radiology 2012;265(1):59–69. [Abstract] [Medline] |
| 79. | Leconte I, Feger C, Galant C, et al.. Mammography and subsequent whole-breast sonography of nonpalpable breast cancers: the importance of radiologic breast density. AJR Am J Roentgenol 2003;180(6):1675–1679. [CrossRef] [Medline] |
| 80. | Corsetti V, Houssami N, Ferrari A, et al.. Breast screening with ultrasound in women with mammography-negative dense breasts: evidence on incremental cancer detection and false positives, and associated cost. Eur J Cancer 2008;44(4):539–544. [CrossRef][Medline] |
| 81. | Bae MS, Han W, Koo HR, et al.. Characteristics of breast cancers detected by ultrasound screening in women with negative mammograms. Cancer Sci 2011;102(10):1862–1867. [CrossRef] [Medline] |
| 82. | Berg WA, Zhang Z, Lehrer D, et al.. Detection of breast cancer with addition of annual screening ultrasound or a single screening MRI to mammography in women with elevated breast cancer risk. JAMA 2012;307(13):1394–1404. [CrossRef] [Medline] |
| 83. | ACRIN 6666: Screening Breast Ultrasound in High-Risk Women. American College of Radiology Imaging Network.http://acrin.org/Portals/0/Protocols/6666/Protocol-ACRIN%206666%20Admin%20Update%2011.30.07.pdf. Published November 9, 2007. |
| 84. | Kelly KM, Richwald GA. Automated whole-breast ultrasound: advancing the performance of breast cancer screening. Semin Ultrasound CT MR 2011;32(4):273–280. [CrossRef] [Medline] |
| 85. | Kelly KM, Dean J, Lee SJ, Comulada WS. Breast cancer detection: radiologists’ performance using mammography with and without automated whole-breast ultrasound. Eur Radiol 2010;20(11):2557–2564. [CrossRef] [Medline] |
| 86. | Chang JM, Moon WK, Cho N, Park JS, Kim SJ. Breast cancers initially detected by hand-held ultrasound: detection performance of radiologists using automated breast ultrasound data. Acta Radiol 2011;52(1):8–14. [CrossRef] [Medline] |
| 87. | Berg WA. Supplemental screening sonography in dense breasts. Radiol Clin North Am 2004;42(5):845–851, vi. [CrossRef] [Medline] |
| 88. | Morrow M, Waters J, Morris E. MRI for breast cancer screening, diagnosis, and treatment. Lancet 2011;378(9805):1804–1811.[CrossRef] [Medline] |
| 89. | Hashimoto BE, Morgan GN, Kramer DJ, Lee M. Systematic approach to difficult problems in breast sonography. Ultrasound Q2008;24(1):31–38. [CrossRef] [Medline] |
| 90. | Abe H, Schmidt RA, Shah RN, et al.. MR-directed (“second-look”) ultrasound examination for breast lesions detected initially on MRI: MR and sonographic findings. AJR Am J Roentgenol 2010;194(2):370–377. [CrossRef] [Medline] |
| 91. | Demartini WB, Eby PR, Peacock S, Lehman CD. Utility of targeted sonography for breast lesions that were suspicious on MRI. AJR Am J Roentgenol 2009;192(4):1128–1134. [CrossRef] [Medline] |
| 92. | Meissnitzer M, Dershaw DD, Lee CH, Morris EA. Targeted ultrasound of the breast in women with abnormal MRI findings for whom biopsy has been recommended. AJR Am J Roentgenol 2009;193(4):1025–1029. [CrossRef] [Medline] |
| 93. | Candelaria R, Fornage BD. Second-look US examination of MR-detected breast lesions. J Clin Ultrasound 2011;39(3):115–121.[CrossRef] [Medline] |
| 94. | Carbognin G, Girardi V, Calciolari C, et al.. Utility of second-look ultrasound in the management of incidental enhancing lesions detected by breast MR imaging. Radiol Med (Torino) 2010;115(8):1234–1245. [CrossRef] |
| 95. | LaTrenta LR, Menell JH, Morris EA, Abramson AF, Dershaw DD, Liberman L. Breast lesions detected with MR imaging: utility and histopathologic importance of identification with US. Radiology 2003;227(3):856–861. [Abstract] [Medline] |
| 96. | Sakamoto N, Tozaki M, Higa K, Abe S, Ozaki S, Fukuma E. False-negative ultrasound-guided vacuum-assisted biopsy of the breast: difference with US-detected and MRI-detected lesions. Breast Cancer 2010;17(2):110–117. [CrossRef] [Medline] |
| 97. | Hlawatsch A, Teifke A, Schmidt M, Thelen M. Preoperative assessment of breast cancer: sonography versus MR imaging. AJR Am J Roentgenol 2002;179(6):1493–1501. [CrossRef] [Medline] |
| 98. | Zhang Y, Fukatsu H, Naganawa S, et al.. The role of contrast-enhanced MR mammography for determining candidates for breast conservation surgery. Breast Cancer 2002;9(3):231–239. [CrossRef] [Medline] |
| 99. | Berg WA, Gutierrez L, NessAiver MS, et al.. Diagnostic accuracy of mammography, clinical examination, US, and MR imaging in preoperative assessment of breast cancer. Radiology 2004;233(3):830–849. [Abstract] [Medline] |
| 100. | Yang W. Staging of breast cancer with ultrasound. Semin Ultrasound CT MR 2011;32(4):331–341. [CrossRef] [Medline] |
| 101. | Moon WK, Noh DY, Im JG. Multifocal, multicentric, and contralateral breast cancers: bilateral whole-breast US in the preoperative evaluation of patients. Radiology 2002;224(2):569–576. [Abstract] [Medline] |
| 102. | Mainiero MB, Cinelli CM, Koelliker SL, Graves TA, Chung MA. Axillary ultrasound and fine-needle aspiration in the preoperative evaluation of the breast cancer patient: an algorithm based on tumor size and lymph node appearance. AJR Am J Roentgenol2010;195(5):1261–1267. [CrossRef] [Medline] |
| 103. | Bedi DG, Krishnamurthy R, Krishnamurthy S, et al.. Cortical morphologic features of axillary lymph nodes as a predictor of metastasis in breast cancer: in vitro sonographic study. AJR Am J Roentgenol 2008;191(3):646–652. [CrossRef] [Medline] |
| 104. | Mainiero MB, Gareen IF, Bird CE, Smith W, Cobb C, Schepps B. Preferential use of sonographically guided biopsy to minimize patient discomfort and procedure time in a percutaneous image-guided breast biopsy program. J Ultrasound Med 2002;21(11):1221–1226.[Medline] |
| 105. | Philpotts LE. Percutaneous breast biopsy: emerging techniques and continuing controversies. Semin Roentgenol 2007;42(4):218–227.[CrossRef] [Medline] |
| 106. | Harvey JA, Moran RE, DeAngelis GA. Technique and pitfalls of ultrasound-guided core-needle biopsy of the breast. Semin Ultrasound CT MR 2000;21(5):362–374. [CrossRef] [Medline] |
| 107. | Parker SH, Jobe WE, Dennis MA, et al.. US-guided automated large-core breast biopsy. Radiology 1993;187(2):507–511. [Abstract][Medline] |
| 108. | Liberman L, Drotman M, Morris EA, et al.. Imaging-histologic discordance at percutaneous breast biopsy. Cancer2000;89(12):2538–2546. [CrossRef] [Medline] |
| 109. | Philpotts LE, Hooley RJ, Lee CH. Comparison of automated versus vacuum-assisted biopsy methods for sonographically guided core biopsy of the breast. AJR Am J Roentgenol 2003;180(2):347–351. [CrossRef] [Medline] |
| 110. | Shah VI, Raju U, Chitale D, Deshpande V, Gregory N, Strand V. False-negative core needle biopsies of the breast: an analysis of clinical, radiologic, and pathologic findings in 27 concecutive cases of missed breast cancer. Cancer 2003;97(8):1824–1831. [CrossRef][Medline] |
| 111. | Crystal P, Koretz M, Shcharynsky S, Makarov V, Strano S. Accuracy of sonographically guided 14-gauge core-needle biopsy: results of 715 consecutive breast biopsies with at least two-year follow-up of benign lesions. J Clin Ultrasound 2005;33(2):47–52. [CrossRef][Medline] |
| 112. | Dillon MF, Hill AD, Quinn CM, O’Doherty A, McDermott EW, O’Higgins N. The accuracy of ultrasound, stereotactic, and clinical core biopsies in the diagnosis of breast cancer, with an analysis of false-negative cases. Ann Surg 2005;242(5):701–707. [CrossRef][Medline] |
| 113. | Povoski SP, Jimenez RE, Wang WP. Ultrasound-guided diagnostic breast biopsy methodology: retrospective comparison of the 8-gauge vacuum-assisted biopsy approach versus the spring-loaded 14-gauge core biopsy approach. World J Surg Oncol 2011;9:87. [CrossRef][Medline] |
| 114. | Bolívar AV, Alonso-Bartolomé P, García EO, Ayensa FG. Ultrasound-guided core needle biopsy of non-palpable breast lesions: a prospective analysis in 204 cases. Acta Radiol 2005;46(7):690–695. [CrossRef] [Medline] |
| 115. | Youk JH, Kim EK, Kim MJ, Kwak JY, Son EJ. Analysis of false-negative results after US-guided 14-gauge core needle breast biopsy. Eur Radiol 2010;20(4):782–789. [CrossRef] [Medline] |
| 116. | Garg S, Mohan H, Bal A, Attri AK, Kochhar S. A comparative analysis of core needle biopsy and fine-needle aspiration cytology in the evaluation of palpable and mammographically detected suspicious breast lesions. Diagn Cytopathol 2007;35(11):681–689. [CrossRef][Medline] |
| 117. | Ciatto S, Cariaggi P, Bulgaresi P. The value of routine cytologic examination of breast cyst fluids. Acta Cytol 1987;31(3):301–304.[Medline] |
| 118. | Rao R, Lilley L, Andrews V, Radford L, Ulissey M. Axillary staging by percutaneous biopsy: sensitivity of fine-needle aspiration versus core needle biopsy. Ann Surg Oncol 2009;16(5):1170–1175. [CrossRef] [Medline] |
| 119. | Gong JZ, Snyder MJ, Lagoo AS, et al.. Diagnostic impact of core-needle biopsy on fine-needle aspiration of non-Hodgkin lymphoma.Diagn Cytopathol 2004;31(1):23–30. [CrossRef] [Medline] |
| 120. | Ko ES, Han H, Lee BH, Choe H. Sonographic changes after removing all benign breast masses with sonographically guided vacuum-assisted biopsy. Acta Radiol 2009;50(9):968–974. [CrossRef] [Medline] |
| 121. | Slanetz PJ, Wu SP, Mendel JB. Percutaneous excision: a viable alternative to manage benign breast lesions. Can Assoc Radiol J2011;62(4):265–271. [CrossRef] [Medline] |
| 122. | Yom CK, Moon BI, Choe KJ, Choi HY, Park YL. Long-term results after excision of breast mass using a vacuum-assisted biopsy device.ANZ J Surg 2009;79(11):794–798. [CrossRef] [Medline] |
| 123. | Kim MJ, Park BW, Kim SI, et al.. Long-term follow-up results for ultrasound-guided vacuum-assisted removal of benign palpable breast mass. Am J Surg 2010;199(1):1–7. [CrossRef] [Medline] |
| 124. | Wang ZL, Liu G, Li JL, et al.. Sonographically guided percutaneous excision of clinically benign breast masses. J Clin Ultrasound2011;39(1):1–5. [CrossRef] [Medline] |
| 125. | Dennis MA, Parker S, Kaske TI, Stavros AT, Camp J. Incidental treatment of nipple discharge caused by benign intraductal papilloma through diagnostic Mammotome biopsy. AJR Am J Roentgenol 2000;174(5):1263–1268. [CrossRef] [Medline] |
| 126. | Bouton ME, Wilhelmson KL, Komenaka IK. Intraoperative ultrasound can facilitate the wire guided breast procedure for mammographic abnormalities. Am Surg 2011;77(5):640–646. [Medline] |
| 127. | Fisher CS, Mushawah FA, Cyr AE, Gao F, Margenthaler JA. Ultrasound-guided lumpectomy for palpable breast cancers. Ann Surg Oncol2011;18(11):3198–3203. [CrossRef] [Medline] |
| 128. | Krekel NM, Lopes Cardozo AM, Muller S, Bergers E, Meijer S, van den Tol MP. Optimising surgical accuracy in palpable breast cancer with intra-operative breast ultrasound: feasibility and surgeons’ learning curve. Eur J Surg Oncol 2011;37(12):1044–1050. [CrossRef][Medline] |
| 129. | Olsha O, Shemesh D, Carmon M, et al.. Resection margins in ultrasound-guided breast-conserving surgery. Ann Surg Oncol2011;18(2):447–452. [CrossRef] [Medline] |
| 130. | DeJean P, Brackstone M, Fenster A. An intraoperative 3D ultrasound system for tumor margin determination in breast cancer surgery.Med Phys 2010;37(2):564–570. [CrossRef] [Medline] |
| 131. | Hsu GC, Ku CH, Yu JC, Hsieh CB, Yu CP, Chao TY. Application of intraoperative ultrasound to nonsentinel node assessment in primary breast cancer. Clin Cancer Res 2006;12(12):3746–3753. [CrossRef] [Medline] |
| 132. | Kiessling F, Fokong S, Koczera P, Lederle W, Lammers T. Ultrasound microbubbles for molecular diagnosis, therapy, and theranostics. J Nucl Med 2012;53(3):345–348. [CrossRef] [Medline] |
Copyright © 2013 Radiological Society of North America | TEL 1-630-571-2670 | TOLL FREE US and Canada: 1-800-381-6660 | Membership 1-877-RSNA-MEM (776-2636)
APPARECCHIATURE E METODOLOGIA DELL’ESAME L’esame ecografico delle mammelle risulta particolarmente impegnativo e difficoltoso per la scarsa differenza di impedenza acustica presente tra i tessuti che compongono tale ghiandola e per la necessità di dover rilevare minimi e sottili dettagli ecostrutturali per la identificazione di eventuali alterazioni focali e ancor più per una differenziazione tra patologie benigne e maligne. Oltre ad indispensabili competenze teoriche e tecniche dello operatore è pertanto necessario utilizzare apparecchiature ecografiche in real-time tecnologicamente d’avanguardia sia per quanto riguarda i sistemi di elaborazione e di rappresentazione del segnale che per quanto riguarda i sistemi di focalizzazione del fascio ultrasonico. Essendo la ghiandola mammaria un organo superficiale, per ottenere una migliore definizione dell’immagine ed un incremento del potere di risoluzione della apparecchiatura risulta indispensabile la utilizzazione di trasduttori ad elevata frequenza potendosi identificare nei 7.5 MHz la frequenza di emissione ottimale. Per uno studio più dettagliato di eventuali alterazioni focali può essere inoltre considerata la utilizzazione di sonde ad elevata frequenza (10-13 e anche 17 MHz). La sonda, lineare o volumetrica per 3D, deve presentare una lunghezza di almeno 5 cm al fine di consentire lo studio di porzioni sufficientemente ampie delle mammelle e di escludere il rischio di una mancata esplorazione di porzioni ghiandolari durante lo spostamento della sonda sulla superficie della mammella. La utilizzazione di sonde dotate degli attuali sofisticati sistemi di focalizzazione può consentire di eseguire l’esame anche senza la interposizione di un distanziatore tra sonda e superficie cutanea. Ciò può risultare comunque utile per una più dettagliata indagine di alterazioni particolarmente superficiali e per un più accurato studio della regione retroareolare specialmente in presenza di capezzoli voluminosi. L’esame ecografico deve essere condotto con paziente supina con il braccio corrispondente alla mammella indagata flesso ed abdotto, con la mano sopra la testa. Questa posizione consente un appiattimento della ghiandola ed una maggiore immobilità nel corso dell’esame. Nel corso dell’esame ecografico devono essere sistematicamente ed accuratamente indagate tutte le porzioni della ghiandola eseguendo uno studio prima per quadranti e poi in senso radiale consentendo queste seconde scanzioni di analizzare più correttamente le strutture del lobo ghiandolare nella sua complessità epiteliale e connettivale e l’asse del dotto che converge verso il capezzolo (Teboul 1988). L’esame ecografico della mammella va quindi completato da un accurato studio di eventuali alterazioni linfonodali in sede ascellare ed a livello della mammaria interna. CRITERI DIAGNOSTICI ECOGRAFICI DELLE ALTERAZIONI FOCALI DELLA MAMMELLA La SIEOG sulla base dei dati della Letteratura Internazionale (Kobayashi 1974, Baum 1977, Kasumi 1982, Kasumi 1991, Leucht 1989) e dell’esperienza del proprio Gruppo di Studio sull’Ecografia della mammella (Gentili 1993) ritiene opportuno che le alterazioni focali della mammella debbano essere sistematicamente indagate sulla base dei seguenti aspetti dell’immagine ecografica: a)Forma- viene definita regolare quando la formazione presenta un aspetto rotondeggiante e grossolanamente ovoidale come nei noduli benigni. I noduli maligni sono invece per lo più caratterizzati da un aspetto non geometrico con contorni angolati e spiculati dovuti ai processi invasivi rispetto al parenchima ghiandolare contiguo. b) Contorno- indica allo stesso tempo sia le caratteristiche morfologiche del contorno del nodulo che può essere sia liscio che frastagliato che la possibilità di una corretta definizione del bordo perimetrale del nodulo che può essere netto o sfumato. c) Alone Iperecogeno- indica la presenza a ridosso del confine del nodulo di una corona di fine iperecogenicità che sfuma nel tessuto ghiandolare contiguo. Tale fenomeno è secondario alla presenza di processi microspiculari che si comportano come microcentri di diffusione rifrangendo le onde del fascio ultrasonico. d) Echi interni le formazioni cistiche risultano transoniche o debolmente ipoecogene in caso di contenuto fluido denso. I noduli solidi benigni sono caratterizzati da echi fini ed omogenei, potendosi, peraltro, talora osservare in età avanzata nel contesto di fibroadenomi piccoli focolai iperecogeni privi di cono d’ombra posteriore dovuti a zone di involuzione fibroialina o grossolane calcificazioni nettamente ecoattenuanti. Nei carcinomi si rileva una marcata ipoecogenicità di fondo nel contesto della quale si possono rilevare echi irregolari e disomogenei e lacune ipoecogene dovute a zone necrotico-colliquative. e) Echi posteriori- l’ecogenicità a livello del tessuto mammario posteriore al nodulo e la possibilità di una corretta definizione della parete posteriore del nodulo stesso dipende dal quadro di attenuazione esercitato sul fascio ultrasonico dalla formazione. È possibile che vi sia una estinzione dell’onda con formazione di un cono d’ombra posteriore in presenza di formazioni nodulari maligne ad elevato contenuto di tessuto fibroso (scirro). In tali casi non risulta definibile la parete posteriore del nodulo né rilevabile l’ecostruttura del tessuto ghiandolare posto inferiormente al nodulo. Si rileva invece un rafforzamento degli echi posteriormente alla formazione in presenza di strutture meno attenuanti del normale tessuto ghiandolare (cisti e noduli solidi benigni ad elevata ed omogenea componente cellulare). È inoltre possibile che gli echi posteriori alla formazione non subiscano significative variazioni rispetto ai tessuti circostanti come avviene nei fibroadenomi. f) Coni d’ombra bilaterali- sono rappresentati da sottili aree di attenuazione del fascio ultrasonico generantesi a livello delle estremità laterali di formazioni rotondeggianti. Frequentemente presenti nelle formazioni benigne (cisti, fibroadenomi) rappresentano una ulteriore riprova del contorno netto e liscio del nodulo. Risultano invece assenti nei noduli maligni ove si possono eventualmente rilevare solo coni d’ombra unilaterali più irregolari e di maggiore intensità. g) Rapporto L/T- indica il rapporto tra il diametro longitudinale (L) e trasverso (T) del nodulo. Qualora prevalga il diametro longitudinale (L/T>1) vi è il sospetto di un processo maligno, mentre qualora prevalga il diametro trasverso (L/T 1 Test compressione Negativo Alterazione del tessuto ghiandolare contiguo (tessuto adiposo, travate fibroconnettivali, dotti galattofori)
Se il seno è denso, infatti, la sensibilità della mammografia, si abbassa dal 80% al 60%. L’ecografia permette, in questi casi, di recuperare circa il 30% di “sensibilità”. Per questo andrebbe fatte insieme: “Eseguire i due esami separatamente non ha alcun razionale scientifico, purtroppo quasi sempre è legato a problemi organizzativi e fattori economici”
Ultrasound is a well-known imaging technique for characterization of breast masses. The American College of Radiology has standardized sonographic findings to establish a common language among radiologists. The shape and margin of the lesion, orientation in relation to the skin, lesion boundary, echotexture, posterior acoustic features, relation to the surrounding parenchyma, and additional findings, such as presence of calcification and vascularization, are described in the lexicon [1].
Vascular elements in solid lesions have been examined with various Doppler techniques, such as color, spectral, and power Doppler. Flow patterns and waveforms are analyzed with spectral Doppler technique, and morphologic features are analyzed with color and power Doppler techniques [2–13]. The following elements are described as characteristic of malignancy: more than one vascular pole; abnormal afferent vascularity (tortuous vessels penetrating the tumor); and hypervascularity with irregular, branching, disorganized intratumoral vessels [3]. Benign lesions tend to have weak and peripheral vascularity and no central vessels [4]. Spectral Doppler analysis has been described as less useful than color Doppler imaging in differentiating benign from malignant masses, having considerable overlap of parameters such as pulsatility and resistance index [14]. Because no reliable standard findings exist, a common language for Doppler findings has not been established. Assessment of lesion vascularity is recommended but is not considered mandatory in the BI-RADS ultrasound lexicon.
Normal vascular anatomy in structures such as the kidneys, lymph nodes, and extremities consists of an artery and one or two veins in the same bundle. Because of their characteristic color pattern and waveforms, these vascular structures are easily identifiable during color and pulsed Doppler evaluation. Malignant tumors stimulate growth of new vessels by secretion of angiogenic factors. These new vessels differ from the native vessels, are morphologically distinct, and are highly tortuous because of their increased endothelial proliferation, high capillary growth rate, and irregular branching and formation of loops [2, 14–17].
We can infer that the presence of an artery and a vein in parallel distribution in the periphery or inside a lesion is a normal anatomic condition that contrasts to the anomalous neovessels generated by tumoral angiogenesis in malignant lesions. We have observed this finding at Doppler ultrasound examination of some breast masses and have called it the parallel artery and vein sign. In this study, we assessed the usefulness of the parallel artery and vein sign in predicting the benign or malignant nature of a breast lesion. We hypothesized that the parallel artery and vein sign is a predictor of a benign pathologic result.
| View larger version (110K) |
Fig. 1 —38-year-old woman with breast mass. Ultrasound images (top row) show parallel blood flow in periphery and interior of breast mass corresponding to artery (red) and vein (blue) and signifying normal anatomic condition. Parallel artery and vein sign is present. Pulsed Doppler ultrasound images confirm venous and arterial characteristics of fluid.
|
| Subjects and Methods |
This study, approved by the institutional review board of our institution, was performed from April 2003 to April 2008. All patients with breast masses undergoing ultrasound-guided biopsy in our department were consecutively enrolled. We used ultrasound systems (ATL HDI5000 SonoCT, IU22 Gemini, Philips Healthcare) with 5–12 and 5–17 MHz transducers and color Doppler mode. Core needle biopsies were performed with an automated gun (Magnum, Bard) and 14-gauge needles.
All ultrasound examinations and Doppler analyses of the breast masses and core needle biopsies were performed by six radiologists with at least 5 years of experience in ultrasound-guided breast procedures. A minimum of six cores per lesion were obtained, as defined by our National Consensus [18]. To ensure uniform performance, before the start of the protocol the radiologists underwent basic training on the pattern of the parallel artery and vein sign. Informed consent was obtained from all patients.
The parallel artery and vein sign was considered present in a mass when two parallel vessels were visualized in the capsule or interior. In this case, one vessel appeared blue and the other red (Fig. 1), indicating the presence of an artery and a vein, which could be confirmed with spectral Doppler imaging. Images of the optimal plane or video captures to confirm the findings were registered and stored in our hospital PACS.
As a standard protocol, all masses were assessed with color Doppler ultrasound before the biopsy procedure. Specific parameters to detect very low blood flow were established on both ultrasound systems with identical settings for every mass (pulse repetition frequency, 700–1000 Hz; wall filter, 50–100 Hz; gain, 85–90%; medium persistence; no window angling). The mass and adjacent breast parenchyma, containing the afferent and efferent vessels, were included in the color box (Fig. 1). The examination was performed with particular care to applying minimal pressure on the masses with the transducer to prevent vessel collapse.
Read More: http://www.ajronline.org/doi/full/10.2214/AJR.10.6130
For a long time, color Doppler ultrasound was not considered a useful tool in the diagnosis of breast disease because it could not be used to accurately differentiate benign from malignant lesions. Along with improvement in the technology, color Doppler ultrasound and power Doppler angiography have become important complements to bidimensional gray-scale breast ultrasound. Although consensus has not been reached on usefulness, these techniques have been proposed as ways to analyze afferent vessels and the internal vascularization of breast masses to improve characterization [5]. We use these techniques systematically as an integral part of our breast ultrasound protocol; all solid masses are studied with color Doppler ultrasound.
In color Doppler ultrasound imaging, blue and red indicate the direction of blood flow with respect to the position of the transducer. When two vessels are found to flow in parallel, blue and red generally indicate a vein and an artery, the presence of which can be confirmed with spectral Doppler imaging (Fig. 1). However, tortuous vessel curling can mimic a similar color Doppler pattern, and aliasing can cause confusion, although the colors in the aliased vessel (most likely an artery, where flow is faster) would appear as a mosaic. Therefore, the parallel artery and vein sign is valid when the color-encoded signal shows a clear blue and red pattern during a Doppler examination. In case of doubt, spectral Doppler technique can be used to confirm the arterial and venous flow patterns. We believe that this limitation does not affect our results; special care was taken in this respect, and spectral Doppler ultrasound was performed in most cases.
The detection of vessels in breast masses depends on the sensitivity of the ultrasound system, the frequency of the transducer used, and the appropriate selection of technical parameters for the study of the breast. To accurately capture very low blood flow and to obtain optimal images of all vessels examined, all necessary technical parameters have to be adjusted (pulse repetition frequency, wall filter, gain, persistence, window), and care has to be taken to avoid compressing the breast with the transducer; excess pressure can collapse the vessel and lead to the interpretation that the lesion is avascular.
Precise semiologic criteria for benign and malignant lesions according to location and morphologic features of the vessels detected have been established [6–13]. The following criteria have 73–98% sensitivity for malignancy and 16–90% specificity [13]: intratumoral vessels without capsular vessels, vascularization of a large percentage of the mass, tortuous neovessels with irregular caliber, penetrating vessels, and a large number of afferent pedicles. This range in sensitivity and specificity is due to the broad variability of equipment and techniques used for analysis, such as color Doppler, power angiography, and contrast administration.
Uno studio sul valore predittivo positivo (PPV) dell’ecografia bilaterale del seno intero (BWBU) per il rilevamento di lesioni mammarie sincrone alla diagnosi iniziale di cancro al seno ha scoperto che BWBU può rilevare tumori maligni sincroni aggiuntivi con un PPV relativamente alto, soprattutto quando i risultati della mammografia sono correlato con i risultati ecografici. In 75 pazienti che avevano lesioni sincrone, il PPV per la biopsia aggiuntiva era del 25,7% (18 su 70). Il PPV per le lesioni sincrone rilevate sia sulla mammografia che sulla BWBU era del 76,9% (10 su 13) e per quelle rilevate solo su BWBU, del 14,3% (7 su 49). I fattori di imaging che erano associati a malignità nella lesione sincrona aggiuntiva erano una massa con calcificazione alla presentazione mammografica (P <0,01), la presenza di calcificazione nei risultati ecografici (P <0,01) e la valutazione finale del sistema di imaging e dati del seno elevato (P <0,01). [49] In uno studio retrospettivo su donne di età inferiore a 40 anni identificate con cancro invasivo (N = 27) o carcinoma duttale in situ (N = 3), l’ecografia è risultata affidabile come modalità di imaging primaria. Delle 30 donne, 28 sono state sottoposte a mammografia (classificata come incerta, sospetta o maligna nella maggioranza) e in un paziente è stata omessa la neoplasia. Tutti i 30 pazienti sono stati sottoposti a ecografia (segnalata come incerta, sospetta o maligna, un’indicazione per la biopsia diagnostica del nucleo) e l’ecografia da sola non ha perso alcun cancro ma non è riuscita a rilevare la malattia multifocale in un paziente. [50]