Imaging: le nuove frontiere DBT/ABUS
Il cancro al seno rappresenta la più comune forma di cancro nella popolazione femminile. Nell’ultimo decennio è aumentata notevolmente l’incidenza del cancro al seno e questo può essere attribuito all’introduzione dei programmi di screening che ne permettono soprattutto una diagnosi precoce [2]. È noto che il tasso di sopravvivenza dipende dallo stadio in cui viene diagnosticato il cancro; quindi, è necessario rilevare il cancro in fase iniziale piuttosto che nelle fasi successive, quando diventa difficile da curare. Inoltre, l’analisi della quantità e del tipo di tessuto presenti nella mammella incidono notevolmente sull’incidenza della patologia. La diagnosi precoce potrebbe ridurre del 20% la mortalità per carcinoma della mammella.
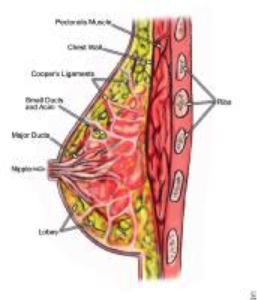
Il seno è una struttura molto complessa, composta da circa 15-20 sezioni chiamate lobi. Ogni lobo è costituito da molte strutture più piccole chiamate lobuli. I lobuli sono disposti in grappoli e alla fine di ogni lobulo ci sono minuscoli “bulbi” che producono latte. I lobi, i lobuli e i bulbi sono collegati tra loro da piccoli tubi chiamati condotti. I dotti portano il latte ai capezzoli, che si trova al centro dell’ areola (l’area più scura che circonda il capezzolo). Gli spazi tra i lobi e i dotti sono pieni di tessuto adiposo.
Figura 1 – Anatomia del seno.
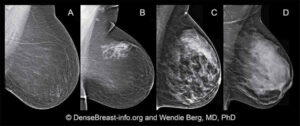
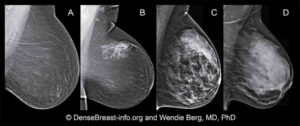
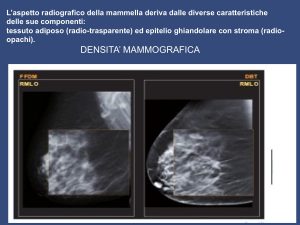
I tessuti fibrosi comprendono legamenti, tessuti di supporto (tessuto mammario denso) e tessuti cicatriziale, il tessuto adiposo (tessuto mammario non denso) riempie gli spazi tra tessuto ghiandolare e fibroso e determina in larga misura la dimensione del seno. In generale, tutto il tessuto non grasso è chiamato tessuto fibroghiandolare. Nella donna non esistono seni uguali, poiché ciascuno contiene una specifica combinazione di tessuto adiposo e denso. I seni di alcune donne sono quasi tutti grassi, mentre altri hanno proporzioni variabili di tessuto adiposo e fibroghiandolare. Con l’aumentare dell’età delle donne, la proporzione di tessuto adiposo aumenta gradualmente, così che all’età di 70 anni circa l’80% di tutte le donne ha un seno composto principalmente da tessuto adiposo.
Il cancro può formarsi in qualsiasi parte del seno e sono necessarie tecniche di imaging appropriate per lo screening nelle donne. Negli ultimi 15 anni l’ecografia si è dimostrata metodica sempre più indispensabile nello studio delle lesioni mammarie grazie soprattutto agli incessanti avanzamenti tecnologici. La qualità dell’immagine ecografica è notevolmente migliorata con l’introduzione di trasduttori ad alta frequenza, dell’imaging armonico, delle applicazioni color e power doppler, e dell’impiego di mezzi di contrasto ecografici. Benché l’ecografia mammaria sia stata adoperata inizialmente con lo scopo di distinguere le lesioni solide da quelle liquide, si è sviluppato un interesse sempre crescente nell’utilizzare gli ultrasuoni per la caratterizzazione delle lesioni solide per identificare le immagini sospette da sottoporre a biopsia da quelle benigne da inviare al follow-up. Il processo di diagnosi diventa più difficile per le donne con seno denso, che hanno un rischio maggiore (4-6 volte) di avere un tumore rispetto a donne con seno adiposo
Il seno femminile contiene quindi diversi tipi di tessuto: adiposo, fibroso e ghiandolare:
- Il tessuto ghiandolare comprende i lobi e i dotti mammari.
- I tessuti fibrosi comprendono legamenti, tessuti di supporto ( tessuto mammario denso ) e tessuti cicatriziali.
- il tessuto adiposo ( tessuto mammario non denso ) riempie gli spazi tra tessuto ghiandolare e fibroso e determina in larga misura la dimensione del seno.
Nella donna non esistono seni uguali, poiché ciascuno contiene una specifica combinazione di tessuto adiposo e denso. I seni di alcune donne sono a prevalenza adiposa, ma sempre di meno nel corso degli anni, mentre altrie hanno proporzioni variabili di tessuto adiposo e fibroghiandolare. Nel 505 dei casi i seni sono a prevalenza fibro-ghiandolare. Con l’aumentare dell’età delle donne, la proporzione di tessuto adiposo aumenta gradualmente, così che all’età di 70 anni circa il 60% di tutte le donne ha un seno composto principalmente da tessuto adiposo. Il cancro può formarsi in qualsiasi parte del seno e sono necessarie tecniche di imaging appropriate per lo screening nelle donne con seno ad elevata densità. ll processo di diagnosi diventa più difficile per le donne con seno denso, che hanno un rischio maggiore (4-6 volte) di avere un tumore rispetto a donne con mammelle adipose.Negli ultimi 15 anni l’ecografia si è dimostrata metodica sempre più indispensabile nello studio delle lesioni mammarie grazie soprattutto agli incessanti avanzamenti tecnologici. La qualità dell’immagine ecografica è notevolmente migliorata con l’introduzione di trasduttori ad alta frequenza, imaging armonico, applicazioni color e power doppler, elastosonografia e con l’impiego di mezzi di contrasto ecografici. Benché l’ecografia mammaria sia stata adoperata inizialmente con lo scopo di distinguere le lesioni solide da quelle liquide, si è sviluppato un interesse sempre crescente nell’utilizzare gli ultrasuoni per la caratterizzazione delle lesioni solide per identificare le immagini sospette da sottoporre a biopsia da quelle benigne da inviare al follow-up e come integrazione alla mammografia nei seni densi..
Le donne sono informate sulla densità del seno e sul rischio di cancro?
Contesto clinico
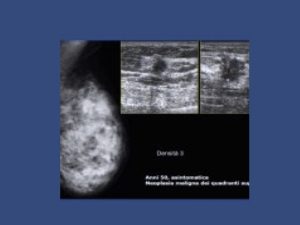
Il seno denso, contenente più ghiandola che tessuto adiposo, è un fattore di rischio indipendente e non modificabile per il cancro al seno e può mascherare il cancro sulle mammografie. La mammografia di screening lo rileva nel 40%-50% delle donne.
A seconda del grado di densità, il tessuto mammario denso è collegato a un rischio di cancro al seno da 1,2 volte superiore a 4 volte superiore rispetto al rischio di cancro al seno di 2 volte superiore con una storia familiare di primo grado. Altri fattori di rischio noti includono l’obesità, l’assunzione di alcol, la parità e la storia di biopsia del seno.
Uno studio qualitativo sulle donne in età da screening del cancro al seno ha scoperto che poche donne hanno identificato la densità del seno come un fattore di rischio per il cancro al seno.
La maggior parte delle donne non si sentiva sicura di sapere quali azioni avrebbero potuto mitigare il rischio di cancro al seno, portando i ricercatori alla conclusione che è necessaria un’educazione completa sui rischi del cancro al seno e sulle strategie di prevenzione.
Lo studio è stato pubblicato all’inizio di quest’anno su JAMA Network Open.[ 1]
“Dal 40 al 50% delle donne sottoposte a mammografia rientrano nelle due più alte categorie di densità al seno”, ha detto una delle autrici dello studio, Christine Gunn, PhD, del Dartmouth Institute for Health Policy and Clinical Practice, New Hampshire “Il rischio di cancro al seno aumenta da 1,2-4,0 volte a seconda del livello di densità del seno. In confronto, una storia familiare di primo grado di cancro al seno, in particolare nelle donne in premenopausa, conferisce un rischio di cancro al seno due volte superiore”.
Lo studio di Gunn si basa su un sondaggio su 2306 donne (di età compresa tra 40 e 76 anni) condotto tra il 2019 e il 2020. L’obiettivo era determinare quanto bene le donne comprendessero i rischi di cancro associati al tessuto mammario denso. L’analisi finale ha incluso 1858 donne (9% asiatiche, 27% nere, 14% ispaniche, 43% bianche e 7% di altre razze o etnie).
Si pensava che la densità del seno fosse un rischio maggiore rispetto al non avere figli, bere quotidianamente e aver avuto una precedente biopsia del seno, secondo il 52%, il 53% e il 48% degli intervistati, rispettivamente. Si credeva che la densità del seno fosse un rischio inferiore al cancro al seno rispetto all’avere un parente di primo grado con cancro al seno dal 93% delle donne, e il 65% delle donne riteneva che fosse un rischio inferiore rispetto al sovrappeso o all’obesità.
Delle 61 donne che hanno completato le interviste di follow-up, 6 hanno descritto la densità del seno come un fattore che contribuisce al rischio di cancro al seno, e 17 donne non sapevano se fosse possibile ridurre il loro rischio di cancro al seno.
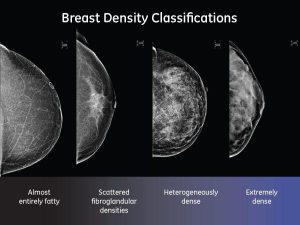
I medici devono informare i pazienti per iscrittoIl tessuto mammario rientra in 1 delle 4 categorie: tessuto adiposo, aree sparse di tessuto fibroglandulare denso, molte aree di tessuto ghiandolare e connettivo o tessuto estremamente denso. Il tessuto è considerato denso se presenta una etereogenea densità o estremamente densa, e in questi casi, possono essere necessari test di follow-up con ecografia o risonanza magnetica (MRI). Questo è importante, ha detto Gunn, perché il tessuto denso può rendere “chi più difficile trovare i tumori perché il tessuto connettivo appare bianco sulla mammografia, potenzialmente mascherando i tumori”.
Studi precedenti hanno scoperto che molti medici sono a disagio a consigliare i pazienti sulle implicazioni della densità del seno e del rischio di cancro, hanno scritto gli autori.
Ai sensi del Mammography Quality Standards Act,[2] che è stato aggiornato il 10 marzo, la FDA richiede che ai pazienti venga fornito un riepilogo del rapporto mammografico che “identifica se il paziente ha tessuto mammario denso o non denso”.
Il rapporto, che dovrebbe essere scritto in linguaggio laico, dovrebbe anche specificare il “significato” del tessuto denso.
Anche se alcuni stati impongono la notifica indipendentemente dal livello di densità, la maggior parte notifica le donne solo se è stato identificato un tessuto eterogeneamente denso o estremamente denso, ha detto Gunn, ma le regole sono incoerenti, ha aggiunto. In alcune strutture del Massachusetts, ad esempio, le donne possono ricevere una lettera di relazione sulla mammografia e una lettera separata sulla densità del seno.
“Per alcuni, è stato davvero confuso. Hanno ricevuto una lettera che diceva che la loro mammografia era normale e poi un’altra che diceva che hanno un seno denso — con conseguente molta incertezza e ansia. Non vogliamo allarmare eccessivamente le persone. Vogliamo che capiscano il loro rischio”, ha detto.
La densità del seno può essere considerata tra gli altri fattori di rischio, tra cui l’uso di alcol, l’obesità, la dieta, la parità, la precedente biopsia del seno e le mutazioni genetiche sfavorevoli ereditarie.
“Se il rischio totale per tutta la vita è superiore al 20%, si aprono ulteriori opzioni di screening, come una risonanza magnetica del seno, che catturerà più tumori di una mammografia del seno da sola”, ha detto Gunn.
“Le sfide per i medici e i pazienti intorno alla raccolta e alla comprensione delle informazioni sulla densità del seno nel contesto di altri fattori di rischio possono potenzialmente portare a disparità in chi conosce il loro rischio e chi no”, ha detto Gunn.
Sarebbe possibile, ha ipotizzato, creare o utilizzare calcolatori di rischio esistenti integrati nelle cartelle cliniche e popolati con informazioni raccolte in questionari di visita premammografica. Idealmente, un radiologo potrebbe consegnare i risultati del paziente in tempo reale alla fine della visita alla mammografia, integrando le stime del rischio con i risultati della mammografia per formulare raccomandazioni.
La densità del seno modifica il panorama dell’imaging mammario
La densità mammografica è un fattore di rischio per lo sviluppo del tumore della mammella ( prevalente componente ghiandolare); ed inoltre è il fattore che determina una minore sensibilità della mammografia (effetto masking) Vachon CM et al. Breast Cancer Res, 2007).






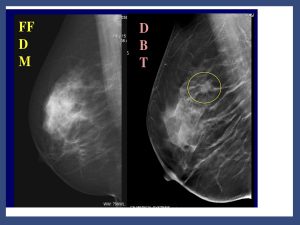
Mammografia 2D/Tomosintesi
Secondo l’American College of Radiology Imaging Network (ACRIN), circa il 40% di tutte le donne sottoposte a mammografia di screening ha seni densi. 4 “C’è il problema del mascheramento del cancro del seno a causa della densità del seno. Tutti concordano poi sul fatto che esiste un maggior rischio di cancro al seno nelle donne con seno denso “, ha affermato Dennis McDonald, direttore medico per l’imaging del seno presso il Sutter Medical Center Sacramento, Sacramento, CA.
Per risolvere il problema, il centro ha implementato il software Volpara per la misurazione della densità del seno, uno strumento di valutazione della densità del seno per migliorare la diagnosi precoce tra nelle donne con seno denso. Volpara genera automaticamente misurazioni oggettive e automatiche dei valori volumetrici della densità del seno con Volpara Density Grade (VDG ® ), un sistema di classificazione correlato con le classificazioni della densità BI-RADS dell’American College of Radiology. Volpara è stato approvato dalla FDA per tutte le unità di mammografia digitale e sono in corso anche l’integrazione con altri sistemi di mammografia digitale, sistemi CAD e soluzioni di segnalazione mammografica.
Ecografia automatica volumetrica ABUS
Nel campo dell’imaging senologico i sistemi tradizionali di Computer Aided Detection (CAD) sono stati progettati in passato utilizzando limitate risorse computazionali e immagini di bassa qualità risultando meno robuste nei processi applicativi. Oggi con gli sviluppi tecnologici è possibile processare immagini 3D di alta qualità; infatti, con la tecnica ABUS (Automated Breast Ultrasound) è possibile produrre una scannerizzazione 3D automatica del seno riducendo la dipendenza dell’operatore. La mammografia a raggi X continua ad essere il gold standard per quanto riguarda l’imaging senologico.

Imaging aggiuntivo
Poichè la popolazione femminile sottoposta a screening presenta un tessuto mammario denso o eterogeneo nel 50% dei casi, molti senologi e radiologi ritengono che la mammografia per queste pazienti debba essere seguita con un test di imaging aggiuntivo, come ultrasuoni o risonanza magnetica o CEM.
La mammografia è ancora oggi considerata il gold-standard per la diagnosi precoce del cancro al seno. Tuttavia, la complessità della valutazione delle strutture mammarie, utilizzando metodi di imaging a raggi X e la sottigliezza delle lesioni precoci, rappresenta una sfida per gli specialisti, in particolare nei casi di seno denso. Sebbene la densità del seno sia un fattore di rischio indipendente per il cancro al seno, il suo effetto di “mascheramento o oscuramento” sulle mammografie ostacola l’individuazione del cancro.
Un recente studio condotto da ACRIN 5 ha riportato che esiste un significativo vantaggio nella rilevazione del cancro al seno integrando lo screening mammografico annuale con ultrasuoni nelle donne ad alto rischio a causa del tessuto mammario denso. Lo stesso studio ha anche scoperto che una singola RM di screening dopo 3 anni di mammografia e screening ecografici annuali identificano ulteriori cancri.
“Questo e altri studi confermano che la mammografia non riesce a evidenziare circa la metà dei tumori presenti nelle donne con seno denso. In queste donne i tumori vengono diagnosticati in stadio più avanzato spesso rilevati clinicamente nell’intervallo tra screening mammografici annuali “, ha detto Wendie Berg, MD, PhD, e professore di Radiologia presso l’Università di Pittsburgh School of Medicine, Magee-Womens Hospital of UPMC, Pittsburgh, PA, “Per le donne che hanno un seno denso, l’aggiunta di ultrasuoni alla mammografia aumenterà la possibilità di trovare il cancro invasivo prima che si diffonda ai linfonodi”, ha detto il dottor Berg.

|
Classificazione ACR BI-RADS: categorie di assegnazione ecografia
Categoria 0 Valutazione incompleta Necessità di ulteriore valutazione diagnostica
Categoria 1 Valutazione completa Negativa
Categoria 2 Segni benigni
Categoria 3 Segni probabilmente benigni; si suggerisce follow-up di breve periodo
Categoria 4 Anormalità sospetta; si dovrebbe prendere in considerazione la biopsia
Categoria 5 Altamente suggestiva di malignità; si dovrebbe intraprendere un appropriato intervento
Categoria 6 Malignità certa; dimostrata dalla biopsia
I noduli mammari studiati ecograficamente vengono spesso sottoposti a biopsia per determinarne la natura. Il gran numero di biopsie eseguite su lesioni benigne o per compiacere le pazienti o per medicina difensiva o per tendenze economicistiche o per l’indicazione di alcuni protocolli, rappresenta un ulteriore problema derivante da una non ottimale specificità dell’ecografia. Infatti, un eccessivo numero di biopsie non necessarie ha un effetto svantaggioso, determinando l’aumento dei costi dei programmi di screening e di tutela della salute pubblica. L’ecografia mammaria in ogni caso non è sfruttata al massimo delle sue potenzialità se il suo utilizzo viene limitato alla sola capacità di differenziare le lesioni liquide da quelle solide o allo studio di seni particolarmente densi. Al fine di diminuire il numero di biopsie non necessarie, l’ecografia dovrebbe tendere ad una sempre più precisa caratterizzazione delle lesioni. Miglioramenti in questo senso si sono registrati in seguito all’introduzione del sistema BI-RADS anche nel campo dell’ecografia mammaria. Tale sistema aiuta il radiosenologo nella descrizione delle caratteristiche ecografiche e nell’assegnazione ad una classe definitiva di appartenenza alla quale è associato il trattamento clinico più appropriato per la paziente. Se questi criteri fossero strettamente applicati a partire dall’iniziale referto radiologico, il numero delle biopsie per le lesioni benigne potrebbe essere ridotto [4].
L’esame ecografico viene comunemente eseguito come complemento alla mammografia nello screening di donne asintomatiche con seno denso, rilevando ulteriori lesioni tumorali in fase iniziale o invasive. In particolare, l’ecografia è obbligatoria per confermare il risultato e per guidare la biopsia della lesione sospetta quando si evidenzia un’anomalia sulla mammografia digitale. Tuttavia, come qualsiasi altro metodo diagnostico, l’ecografia presenta problemi legati alla sua sensibilità e specificità. La sua implementazione più ampia è anche limitata dal tipo di dispositivo impiegato e dal fatto che sia operatore-dipendente[5], pertanto manca di standardizzazione e riproducibilità e richiede notevole tempo medico per l’acquisizione. La crescente preoccupazione di medici e pazienti per l’aumento del rischio di cancro al seno correlato all’elevata densità del seno, combinata con i limiti della mammografia nei seni densi, ha portato allo sviluppo di ulteriori strumenti di screening, tra cui l’ecografia mammaria automatizzata ABUS. Consapevolezza del seno denso
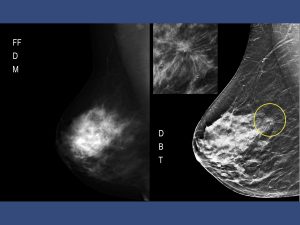
È ben noto che la densità mammografica del seno – una conseguenza delle proporzioni di grasso, tessuto connettivo e tessuto epiteliale nel seno – è un fattore di rischio per il cancro al seno. Uno studio recente ha rilevato che le donne con tessuto denso nel 75% dei casi hanno un rischio di tumore al seno da 4 a 6 volte maggiore rispetto alle donne con tessuto poco denso o per niente denso. 1 Uno studio condotto da medici della Harvard Medical School e di Brigham and Women’s Hospital, Boston, MA e colleghi, ha rilevato che una maggiore densità mammografica è associata a caratteristiche tumorali più aggressive ma anche a tumori in situ. 2 Gli autori hanno scritto: “il mascheramento di un tumore può verificarsi perché il tessuto neoplastico e il tessuto mammograficamente denso hanno un’attenuazione dei raggi X simile, consentendo ai tumori di non essere rilevati all’esame mammografico di screening e di progredire verso uno stadio più avanzato e aggressivo prima del rilevamento, raccomandando “la densità mammaria dovrebbe essere inclusa nei modelli di predizione del rischio tra i sottotipi di tumore”. Questi e altri studi sullo screening mammografico per donne con seni densi hanno catalizzato un movimento per la consapevolezza del seno denso. In precedenza, la crescente preoccupazione sull’efficacia delle mammografie su donne con seni densi aveva spinto il Connecticut a emanare una legge nel 2009 che richiedeva che le donne fossero informate della loro densità mammaria quando ricevevano i loro referti mammografici. La legislazione correlata nello stesso stato stabilisce che le compagnie assicurative forniscano copertura per uno screening ecografico completo di un seno intero o di un seno se un mammogramma dimostra tessuto mammario eterogeneo o denso basato sul sistema di classificazione (BI-RADS) stabilito dall’American College di Radiologia (ACR). 3 Da allora, molti altri stati hanno emanato leggi simili per la notifica della densità del seno. 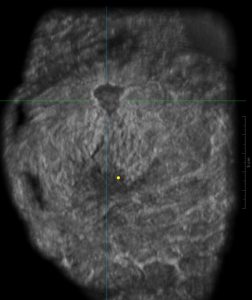 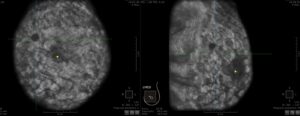 La tecnica ABUS è un metodo dedicato che esegue, in modo automatizzato e standardizzato, la scansione del seno con un trasduttore ad alta frequenza a curva inversa con un campo visivo che è almeno di tre volte più grande di un trasduttore a ultrasuoni convenzionale. Ciò fornisce una rappresentazione tridimensionale del tessuto mammario e consente la riformattazione dell’immagine su tre piani.
 In ABUS l’acquisizione delle immagini viene eseguita, con un’eccellente risoluzione e un piano coronale aggiuntivo, da tecnici di radiologia, il che consente ai medici di dedicare il loro tempo all’interpretazione delle immagini e consente di implementare il metodo su larga scala. Il piano coronale generato è utile per migliorare l’accuratezza diagnostica. Negli ultimi anni numerosi studi hanno valutato il suo utilizzo non solo nel contesto di screening, ma anche in ambiente diagnostico. Il sistema ABUS è dotato di avanzati algoritmi di imaging con ottimizzazione dell’immagine che includono: equalizzazione dei tessuti, compensazione dell’ombra del capezzolo, rilevamento del bordo del seno e rilevamento della parete toracica. Tutti questi algoritmi servono a minimizzare il più possibile gli artefatti in modo che il medico responsabile possa concentrarsi sull’essenziale: l’anatomia. Tipicamente un esame con sistema ABUS prevede tre acquisizioni per ogni mammella: antero-posteriore (AP), laterale (LAT) e mediale (MED). Le varie acquisizioni verranno sovrapposte per ottenere una miglior visione della zona centrale del seno, dove il tessuto ghiandolare presenta maggiore densità. Il numero di acquisizioni può variare in base al volume mammario, infatti grazie alla grafica intuitiva del pannello di controllo, l’operatore può personalizzare i protocolli d’esame per acquisizioni aggiuntive, superiore (SUP) e inferiore (INF), nei seni di maggiore dimensione o in presenza di protesi adattative. Ciascuna acquisizione richiede meno di un minuto e nelle pazienti con seno di minori dimensioni l’acquisizione può essere di minor durata.
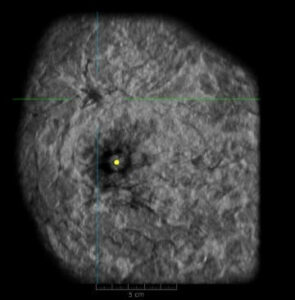 Diversi studi clinici dimostrano la necessità di screening supplementare per pazienti con tumore al seno con tessuto mammario denso Rispetto alla sola mammografia, l’imaging di ABUS osserva in modo diverso il tessuto mammario denso, fornendo una visione completa del seno. Lo screening con ABUS supplementare alla mammografia ha permesso un aumento relativo del 37% nel rilevamento del cancro in generale rispetto alla sola mammografia e un aumento relativo dell’identificazione dei tumori al seno invasivi nel tessuto mammario denso del 55%. [11] Numerosi studi dimostrano che quando ABUS è usato in aggiunta alla mammografia, i piccoli tumori rilevati solo attraverso l’ABUS sono risultati prevalentemente invasivi e con linfonodi negativi, rilevando i tumori in una fase più precoce e curabile. [12] Questo ha importanti implicazioni prognostiche e può ridurre il costo delle cure. Quando i tumori al seno si trovano allo stadio 1 e 2, il 70% dei pazienti può evitare la chemioterapia. [13] Gli studi clinici hanno confermato la stadiazione accurata, economica e non invasiva dei tumori al seno prima dell’intervento chirurgico grazie all’acquisizione del piano coronale che rappresenta una visione intera e completa del tessuto.
Questa prospettiva globale mostra chiaramente distorsioni architettoniche e malattie multifocali. Poiché sul piano coronale la mammella è vista come sul tavolo operatorio, questo piano è noto come piano chirurgico. Questa vista migliora la valutazione dei bordi delle lesioni. Le lesioni benigne sono spesso circondate da un bordo iperecogeno continuo, mentre le lesioni maligne presentano spesso un bordo iperecogeno discontinuo. [14] Inoltre, in questo piano, i tumori sono riconosciuti come “black holes”, frequentemente associati ad un fenomeno di retrazione rappresentato dall’infiltrazione tumorale e dalla reazione desmoplastica del tessuto circostante contro il tumore maligno, presentandosi come linee rette iperecogene che si irradiano dal la superficie del nodulo. ABUS ha mostrato risultati promettenti per la valutazione preoperatoria dell’estensione del tumore. Zelst et al. [15] hanno trovato una correlazione positiva tra un “indice del fenomeno di spiculazione e retrazione” valutato nel piano coronale e la probabilità di cancro. Il fenomeno della retrazione è correlato statisticamente con dimensioni del tumore più piccole, grado istologico inferiore e stato positivo dei recettori per estrogeni e progesterone. Il piano coronale consente la ricostruzione del sistema duttale dell’intera mammella, che facilita l’individuazione della dilatazione duttale associata a lesioni papillari intraduttali, o anche del carcinoma duttale in situ, rilevando echi intraluminali nei dotti lattiferi dilatati. La tecnologia di ABUS fornisce immagini riproducibili per la posizione della lesione mammaria, la misurazione delle dimensioni e la caratterizzazione, che si sono rivelate utili, specialmente in situazioni cliniche che richiedono l’imaging di follow-up. La variazione della pressione di scansione può influenzare la profondità e le caratteristiche della lesione. Inoltre, le ricostruzioni coronali portano nuove informazioni diagnostiche. Rispetto alla HHUS, che viene eseguita dai medici e richiede 20 min per paziente, il tempo che il radiologo impiega in ABUS è legato solo alla valutazione delle immagini perché l’acquisizione è effettuata dal tecnico. Grazie a questo vantaggio, ABUS può essere utilizzato come strumento alternativo nello screening delle donne con seno denso. L’edema post-traumatico o post-terapeutico, o da mastite infettiva o carcinomatosa, provoca la comparsa di aree di attenuazione diffusa all’interno del parenchima ghiandolare. L’artefatto “white wall sign” si osserva con masse transoniche (cisti) o alcune masse solide come in HHUS; si presenta come una parete ecogena nella vista coronale e corrisponde al miglioramento acustico su HHUS. Appare posteriormente alla lesione a causa di ultrasuoni meno attenuati all’interno della lesione. Può aiutare l’interpretazione, ma non è specifico per le masse benigne a causa del fatto che anche i carcinomi di alto grado possono presentare questo artefatto. Le patologie che possono rappresentare cause di falsi positivi sono l’adenosi, il papilloma intraduttale, il fibroadenoma o la mastite [12]. Le immagini ABUS sono immagini in sezione e statiche. Questa peculiarità tecnica apre la possibilità di ottenere risultati falsi positivi in cisti complicate che mimano lesioni cistiche complesse. In queste situazioni, l’HHUS può ovviare in tempo reale al fatto che l’aspetto intracistico è prodotto solo da echi fluttuanti. Piccole lesioni, bordi circoscritti (come nel carcinoma midollare, nei tumori filloidi o nel carcinoma papillare solido invasivo) o la localizzazione periferica della massa possono essere fonti di risultati falsi negativi [12].
L’artefatto “white wall sign” si osserva con masse transoniche (cisti) o alcune masse solide come in HHUS; si presenta come una parete ecogena nella vista coronale e corrisponde al miglioramento acustico su HHUS. Appare posteriormente alla lesione a causa di ultrasuoni meno attenuati all’interno della lesione. Può aiutare l’interpretazione, ma non è specifico per le masse benigne a causa del fatto che anche i carcinomi di alto grado possono presentare questo artefatto. ]. La rimozione o la riduzione significativa degli artefatti e l’abbassamento dei risultati falsi positivi o negativi possono essere ottenuti attraverso un rigoroso addestramento dei tecnici di radiologia per rispettare il posizionamento del paziente, un appropriato contatto trasduttore-pelle, un uso adeguato della lozione e una scansione completa del tessuto ghiandolare nelle regioni periferiche, soprattutto dei seni più grandi. Inoltre, l’ottimizzazione della pressione di scansione è necessaria per ottenere un’elevata riproducibilità dei dati, tuttavia, non ci sono studi che riportino dati conclusivi sulla pressione di compressione ottimale. Kim et al. [22] ha inoltre proposto l’uso di un cuscinetto di gel specifico posto sul seno per ridurre il dolore a causa della pressione di scansione ed evitare artefatti di difetto di contatto. Ciò consente anche di espandere l’area scansionata. |
|
Vi sono ormai consolidate evidenze che la mammografia 3D (tomosintesi) sia più sensibile della mammografia digitale tradizionale. Non solo migliore sensibilità ma anche maggiore specificità.
Lavoro di Cristen Bolen con revisione redazionale
Negli Stati Uniti con le nuove leggi sulla notifica della densità del seno, i radiologi sono preoccupati che la mammografia digitale bidimensionale (2D) da sola potrebbe non essere sufficiente per lo screening di pazienti con seni densi. Molti centri di imaging mammario stanno cercando di espandere il loro arsenale di tecnologie di screening. Alcuni di questi strumenti di screening complementare includono l’ecografia mammaria automatizzata (ABUS), la tomosintesi, la Cesm, l’imaging opto-acustico, la risonanza magnetica mammaria (MRI) e l’imaging molecolare della mammella (MBI). Ogni dispositivo di imaging offre una vista aggiuntiva o alternativa che può rilevare lesioni nel seno che potrebbero altrimenti passare inosservate.
TOMOSINTESI
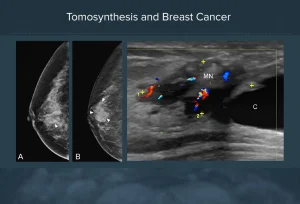
E’ indubbio che il modo più naturale ed efficace per rimuovere il cosiddetto rumore strutturale in mammografia consista nel separare fisicamente le varie strutture anatomiche del seno. La mammografia rappresenta infatti una proiezione bidimensionale di una struttura tridimensionale per cui, geometricamente, tessuti appartenenti a piani diversi risultano sovrapposti nell’immagine radiografica. Non c’è nulla di nuovo in tutto ciò, semplicemente la tecnologia tomografica ha raggiunto la maturità anche per la diagnosi precoce del tumore al seno per cui sistemi dedicati sono in fase di applicazione clinica.
La tomosintesi è tecnica più sensibile della mammografia 2D perché ottimizza i vari aspetti menzionati. L’impianto mammografico viene modificato per consentire alla sorgente radiogena di ruotare ed eseguire radiografie del seno a diversi angoli di proiezione; le immagini digitali, acquisite a bassa dose, sono poi opportunamente combinate per ricostruire le sezioni a diversa profondità. La tomosintesi in pratica è una mammografia migliore. Nata per superare i limiti della mammografia digitale 2D la tomosintesi permette di ricostruire una stratigrafia della mammella a partire da un numero finito di proiezioni bidimensionali. Di ultimissimo sviluppo è il CAD che mediante marker segnala le aree di maggiore interesse.
- Digital breast tomosynthesis (DBT): è una tomografia ad angolo limitato applicata alla mammografia
- E’ tecnologia di recente introduzione e di forte impatto per la detezione e la diagnosi della patologia mammaria.
- Permette di ricostruire a strati secondo piani paralleli al detector 2 D, con un effetto “pseudo 3D”.
Ciò contribuisce a ridurre gli artefatti da sovrapposizione o sommazione e ad ovviare al mascheramento delle lesioni relativo alla densità mammaria. La tomosintesi è in grado di visualizzare separatamente oggetti posti a profondità diverse tramite l’acquisizione di molteplici proiezioni bidimensionali a bassa dose per diverse angolazioni del tubo rx intorno alla mammella con detettore fermo. I dati acquisiti vengono ricostruiti in una serie di strati sottili ad alta risoluzione.
Le finalità
- Individuare lesioni che ora sfuggono alla mammografia digitale riducendo i cancri d’intervallo
- Ridurre il numero dei falsi positivi
- Incidere sul tasso di richiami nei programmi di screening
La tomosintesi è in grado di visualizzare separatamente oggetti posti a profondità diverse tramite l’acquisizione di proiezioni a bassa dose per diverse angolazioni del tubo rx intorno alla mammella con detettore fermo. I dati acquisiti vengono ricostruiti in una serie di strati sottili ad alta risoluzione. A differenza della Mammografia, in cui i tessuti appartenenti a piani dello spazio diversi risultano sovrapposti nella immagine mammografica, nella Tomosintesi è possibile esaminare la mammella a strati di piccolo spessore, e quindi avere una precisa immagine di ogni strato, riducendo le “false” immagini dovute alla sovrapposizione delle strutture, tipica della Mammografia.
Fino a poco tempo fa l’esecuzione della Mammografia 3D comportava un’esposizione aggiuntiva ai raggi X, rispetto alla Mammografia 2D. Oggi invece grazie al software C-View, permette di eseguire Mammografia 2D e Tomosintesi con la stessa dose della Mammografia “low dose”, quindi con minima esposizione della paziente ai raggi X. Le immagini della Tomosintesi sono esaminate assieme alle immagini 2D, essenziali per la valutazione della mammella nel suo insieme, il confronto con gli esami precedenti e il rapido riconoscimento delle microcalcificazioni
La ricostruzione 3D supera i limiti della Mammografia 2D dovuti a densità mammaria e sovrapposizione dei tessuti che determinano mascheramento e misconoscimento dei tumori.
Limiti della mammografia
● mammelle opache, ghiandolari,
● sede marginale del tumore,
● scarsa densità (opacità) intrinseca del tumore,
● tumore molto piccolo,
● contorni regolari di alcuni tumori,
● difetti di apparecchiature e di esecuzione dell’esame.
La differenza più importante con la mammografia è l’uso di una sorgente a raggi X in movimento in tomosintesi. Durante un esame di tomosintesi, la sorgente a raggi x si muove dopo un arco sopra il seno e acquista diverse proiezioni. Alla fine, vengono ottenute numerose immagini, ognuna delle quali mostrando uno strato del seno [ 19 , 20 , 21]. La tomosintesi può essere acquisita come un’immagine aggiuntiva ai mammografi usuali o può essere acquisita da sola. Quest’ultimo protocollo è possibile perché le immagini molto simili ai mammografie usuali possono essere ricostruite dal set dei dati di tomosintesi: questi cosiddetti mammografi sintetici possono evitare la necessità di acquisire i mammografie originali originali [ 20 , 22 ]. Secondo il dispositivo utilizzato, l’esposizione alle radiazioni è uguale a leggermente superiore rispetto alla mammografia, ma è ancora nei limiti raccomandati dalle linee guida internazionali sulla sicurezza delle radiazioni [ 23]. I risultati di diversi studi che confrontano solo la mammografia con la mammografia con tomosintesi hanno dimostrato che la tomosintesi è in grado di aumentare significativamente il rilevamento del cancro fino al 30-40% [ 21 ].
La tomosintesi è già usata come modalità di screening negli Stati Uniti. In Europa, solo alcuni centri eseguono la tomosintesi nei programmi di screening organizzati, soprattutto nel contesto di programmi di ricerca approvati dai comitati etici. I risultati di questi studi sono promettenti. Tre studi prospettici hanno dimostrato che DBT utilizzato come test aggiuntivo [ 24 , 25 , 26 ] o alternativa [ 27 ] ai comuni mammografi digitali consente una prestazione diagnostica superiore rispetto alla mammografia da solo. Nel complesso, la tomosintesi fornisce un aumento del tasso di rilevazione da 0,5 a 2,7 per 1000 donne schermate, nonché una riduzione del tasso di richiamo da 0,8 a 3,6 per 100 donne schermate [ 28]. Tutti questi aspetti conferiranno probabilmente alla tomosintesi lo status di futura mammografia di routine anche nell’ambito dello screening.
Tuttavia, prima di introdurre la tomosintesi nella screening del cancro al seno al di fuori di prove eticamente omologate, ci dovrebbe essere prova di una riduzione statisticamente significativa e clinicamente rilevante del tasso di tumore dell’intervallo. Questa cautela è dovuta alla necessità di evitare un aumento dei costi. I primi risultati di una riduzione da 0,7 a 0,5 intervalli di cancro per 100 donne scrinate sono stati recentemente riportati da un grande studio negli Stati Uniti [ 29 ], ma ulteriori prove sono necessarie.
Durante l’esame del seno eseguito al di fuori dell’ambiente di screening, è la scelta del radiologo di eseguire solo mammografia, di associare tomosintesi e / o ultrasuoni, oppure di eseguire la tomosintesi senza mammografia standard e di ottenere mammografia sintetica ricostruita. Questa decisione si basa su vari aspetti: le caratteristiche del seno, la disponibilità di esami precedenti, la disponibilità della tecnologia e anche la preferenza del radiologo in relazione al caso specifico.
Per le donne: Nota I. Se siete invitati a partecipare a un programma di screening in cui la tomosintesi è proposta nel contesto di uno studio o come pratica di routine, considerate che i potenziali vantaggi della tomosintesi in termini di aumentato rilevamento del cancro e ridotto tasso di richiamo dovrebbero superare il trascurabile aumento dose di radiazioni.
Gli studi clinici pubblicati hanno dimostrato che la tomosintesi ha dimostrato un incremento in sensibilità e in specificità’ con una riduzione dei falsi positivi compresa tra il 17 e il 37%, consentendo di riconoscere neoplasie non visibili con la mammografia bidimensionale, dal 27 al 40% in più a seconda degli studi e di meglio definire le eventuali alterazioni presenti.
I VANTAGGI DELLA MAMMOGRAFIA DIGITALE 3D CON TOMOSINTESI
- Analisi più accurata eliminando gli artefatti da sovrapposizione del tessuto fibroghiandolare, incrementando la risoluzione spaziale e riducendo i falsi negativi e i falsi positivi. I falsi negativi della mammografia digitale oscillano dal 10 al 30%.2. La dose di radiazione ampiamente al di sotto della dose di sicurezza, sostanzialmente analoga alla mammografia digitale ma di gran lunga inferiore rispetto alla mammografia analogica.3. La Tomosintesi c-view permette l’esecuzione della mammografia in 3D con ricostruzione mediante algoritmo matematico di una immagine 2D.
Vantaggi:
- riduzione numero richiami
- maggior valore predittivo positivo
- minor numero di falsi positivi e falsi negativi
- riduzione dei cancri intervallo
- miglior indice di concordanza diagnostica
In tomosintesi i particolari anatomici realmente presenti nel piano esaminato, appaiono perfettamente “a fuoco” e quindi con una evidenza (rapporto segnale/rumore) molto maggiore.
La ricostruzione a strati della tomosintesi riduce o elimina i problemi causati dalla sovrapposizione dei tessuti, anche se il limitato angolo di rotazione (rispetto alla rotazione di 360° della TC) non consente una completa cancellazione dei particolari contenuti nei piani sovra o sottostanti rispetto a quello di interesse (“ombre di trascinamento”).
Uno studio recente ha analizzato i risultati di 12.631 esami interpretati utilizzando la sola mammografia e la mammografia più la tomosintesi. I ricercatori hanno scoperto che con la mammografia più la tomosintesi c’era un aumento del 31% nel tasso di identificazione del cancro; il tasso di falsi positivi era del 13% in meno; e c’è stato un aumento del 26% nel rilevamento di tumori di grado elevato. 6
In un altro studio, condotto da Liane Philpotts, MD, Chief of Breast Imaging presso la Yale University School of Medicine di New Haven, CT, gli investigatori hanno concluso che l’aggiunta di 3D a un esame di screening ha ridotto i tassi di richiamo del 40%. 7
Benché l’ecografia mammaria sia stata utilizzata inizialmente con lo scopo di distinguere le lesioni solide da quelle liquide, si è sviluppato un interesse sempre crescente nell’utilizzare gli ultrasuoni per la caratterizzazione delle lesioni solide per identificare le immagini sospette da sottoporre a biopsia da quelle benigne da inviare al follow-up. Il processo di diagnosi diventa più difficile per le donne con seno denso, che hanno un rischio maggiore (4-6 volte) di avere un tumore canceroso rispetto a donne con seno grasso o non denso.
È stato dimostrato che la sensibilità dell’ecografia è superiore a quella della mammografia nella valutazione delle mammelle dense e l’ecografia gioca un ruolo fondamentale nelle procedure interventistiche come l’esecuzione di ago aspirati e biopsie e nelle localizzazioni pre-operatorie [3].
Tabella 1 Classificazione ACR BI-RADS: categorie di assegnazione
Categoria
Valutazione incompleta
Categoria 0 Necessità di ulteriore valutazione diagnostica Valutazione completa
Categoria 1 Negativa
Categoria 2 Segni benigni
Categoria 3 Segni probabilmente benigni; si suggerisce follow-up di breve periodo
Categoria 4 Anormalità sospetta; si dovrebbe prendere in considerazione la biopsia
Categoria 5 Altamente suggestiva di malignità; si dovrebbe intraprendere un appropriato intervento
Categoria 6 Malignità certa; dimostrata dalla biopsia
Per la frequente sovrapposizione di segni benigni e maligni, i noduli mammari studiati ecograficamente vengono spesso sottoposti a biopsia per determinarne la natura. Il gran numero di biopsie eseguite su lesioni benigne o per desiderio delle pazienti o per l’incertezza del medico o per l’indicazione di alcuni protocolli, rappresenta un ulteriore problema. Infatti, un eccessivo numero di biopsie non necessarie ha un effetto svantaggioso, determinando l’aumento dei costi dei programmi di screening e di tutela della salute pubblica. L’ecografia mammaria non è sfruttata al massimo delle sue potenzialità se il suo utilizzo viene limitato alla sola capacità di differenziare le lesioni liquide da quelle solide o allo studio di seni particolarmente densi. Al fine di diminuire il numero di biopsie non necessarie, l’ecografia dovrebbe tendere ad una sempre più precisa caratterizzazione delle lesioni.
Miglioramenti in questo senso si sono registrati in seguito all’introduzione del sistema BI-RADS anche nel campo dell’ecografia mammaria.
Tale sistema aiuta il radiologo nella descrizione delle caratteristiche ecografiche e nell’assegnazione ad una classe definitiva di appartenenza alla quale è associato il trattamento clinico più appropriato per la paziente. Se questi criteri fossero strettamente applicati a partire dall’iniziale referto radiologico, il numero delle biopsie per le lesioni benigne potrebbe essere ridotto [4].
Cos’è la tecnologia ABUS e quali sono le principali applicazioni
La mammografia è ancora oggi considerata il gold-standard per la diagnosi precoce del cancro al seno. Tuttavia, la complessità della valutazione delle strutture mammarie, utilizzando metodi di imaging a raggi X rappresenta una sfida per gli specialisti, in particolare nei casi di seno denso. Sebbene la densità del seno sia un fattore di rischio indipendente per il cancro al seno, il suo effetto di “mascheramento o oscuramento” sulle mammografie ostacola l’individuazione del cancro.
L’ esame ecografico viene comunemente eseguito come complemento alla mammografia nello screening di donne asintomatiche con seno denso, rilevando ulteriori lesioni tumorali in fase iniziale o invasive. In particolare, l’ecografia portatile (HHUS) è obbligatoria per confermare il risultato e per guidare la biopsia della lesione sospetta quando si evidenzia un’anomalia sulla mammografia digitale. Tuttavia, come qualsiasi altro metodo diagnostico, l’ecografia presenta problemi legati alla sua sensibilità e specificità. La sua implementazione più ampia è anche limitata dal tipo di dispositivo impiegato e dal fatto che dipende dall’abilità dell’operatore [5], pertanto manca di standardizzazione e riproducibilità e richiede notevole tempo medico per l’acquisizione.
La crescente preoccupazione di medici e pazienti per l’aumento del rischio di cancro al seno correlato all’elevata densità del seno, combinata con i limiti della mammografia nei seni densi, ha portato allo sviluppo di ulteriori strumenti di screening , tra cui l’ ecografia mammaria automatizzata ABUS.
La tecnica ABUS è un metodo dedicato che esegue, in modo automatizzato e standardizzato, la scansione del seno con un trasduttore ad alta frequenza a curva inversa con un campo visivo che è almeno di tre volte più grande di un trasduttore a ultrasuoni convenzionale. Ciò fornisce una rappresentazione tridimensionale del tessuto mammario e consente la riformattazione dell’immagine su tre piani.
In ABUS l’acquisizione delle immagini viene eseguita, con un’eccellente risoluzione e un piano coronale aggiuntivo, da tecnici di radiologia, il che consente ai medici di dedicare il loro tempo all’interpretazione delle immagini e consente di implementare il metodo su larga scala. Il piano coronale generato è stato suggerito per migliorare l’accuratezza diagnostica.
Negli ultimi anni numerosi studi hanno valutato il suo utilizzo non solo nel contesto di screening, ma anche in ambiente diagnostico : hanno mostrato la sua idoneità per la stadiazione del cancro al seno, la valutazione della risposta tumorale alla chemioterapia neoadiuvante e il second-look ecografico dopo risonanza magnetica. Vari studi hanno dimostrato che l’utilizzo del sistema ABUS, abbinato alla mammografia, aumenta l’accuratezza nella diagnosi dei tumori al seno.
Nel 2012, ABUS è stata approvata dalla Food and Drug Administration statunitense come test di screening per pazienti con seno denso; tuttavia, non è ancora disponibile in tutte le cliniche di imaging negli Stati Uniti [6].
Funzionamento e tecnologia ABUS
Il sistema ABUS, illustrato nella Figura 1 (Invenia; GE Healthcare; Sunnyvale, CA, USA), consiste in un’unità di scansione che contiene un trasduttore lineare ad alta frequenza (10-15 MHz) e una workstation diagnostica.
Dopo aver posizionato la sonda, l’operatore avvia l’acquisizione volumetrica mediante un tasto posizionato sul manipolo dell’apparecchiatura; il trasduttore motorizzato si muove in modo automatico lungo l’area da esaminare.
Il sistema ABUS è dotato di avanzati algoritmi di imaging intelligenti con ottimizzazione dell’immagine che includono: equalizzazione dei tessuti, compensazione dell’ombra del capezzolo, rilevamento del bordo del seno e rilevamento della parete toracica. Tutti questi algoritmi servono a minimizzare il più possibile gli artefatti in modo che il medico responsabile possa concentrarsi sull’essenziale: l’anatomia.
Tipicamente un esame con sistema ABUS prevede tre acquisizioni per ogni mammella: antero-posteriore (AP), laterale (LAT) e mediale (MED). Le varie acquisizioni verranno sovrapposte per ottenere una miglior visione della zona centrale del seno, dove il tessuto ghiandolare presenta maggiore densità. Il numero di acquisizioni può variare in base al volume mammario, infatti grazie alla grafica intuitiva del pannello di controllo, l’operatore può personalizzare i protocolli d’esame per acquisizioni aggiuntive, superiore (SUP) e inferiore (INF) , nei seni di maggiore dimensione o in presenza di protesi adattative. Ciascuna acquisizione richiede meno di un minuto e nelle pazienti con seno di minori dimensioni l’acquisizione può essere di minor durata. Una volta ultimata l’acquisizione dei dati, l’apparecchio ricostruisce il volume del seno e genera un’immagine 3D volumetrica della mammella sul piano frontale.
L’ecografo portatile tradizionale dipende dall’operatore, con lunghi tempi di acquisizione, ed è limitato alle aree di interesse, note come zone focali. Le aree al di fuori della zona focale hanno una ridotta risoluzione. L’aumento delle zone focali può aumentare la risoluzione, ma diminuisce la frequenza dei fotogrammi. La tecnologia a fascio largo sterzato di ABUS crea dei pixel focalizzati in ogni punto dell’immagine risultante in un’immagine ad alta risoluzione, fino a 5 cm di profondità; quindi, ABUS non dipende dalle zone focali. Il trasduttore a curva inversa emette più fasci larghi per ogni frame con vari angoli di trasmissione per ogni onda, e questo crea un pixel focalizzato in ogni punto all’interno dell’immagine. ABUS ricostruisce 3 milioni di pixel al secondo ad alta frequenza per calcolare un intero volume mammario 3D da una singola scansione.
La tecnologia ABUS possiede una potente architettura di imaging che consente performance eccezionali e rapidi risultati di imaging del seno, passando dall’elaborazione hardware a quella software. La tecnologia con cui lavora acquisisce ed elabora molti più dati e li utilizza per creare volumi significativi (circa tre volte più grandi rispetto a quelli ottenuti con gli ultrasuoni tradizionali), con un’eccellente qualità dell’immagine. I parametri convenzionali degli ultrasuoni portatili, come le zone di messa a fuoco e il guadagno, vengono ottimizzati automaticamente. Ogni pixel è quindi automaticamente a fuoco.
Dopo l’acquisizione, le serie di immagini assiali vengono inviate a una workstation dedicata e combinate per formare l’immagine ecografica 3D che può essere esaminata in ricostruzioni multiplanari, tra cui immagini coronali e sagittali di 2 mm di spessore, parallelamente alla parete toracica (Figura 7) [7]. L’opzione di layout a tre viste mostra una vista sincronizzata di più acquisizioni su un’unica schermata, consentendo ai medici di valutare e incrociare in modo efficiente le aree di interesse da più angolazioni e aumentare l’affidabilità diagnostica. Rendering 3D completamente focalizzati e la ricostruzione dei piani coronali sono calcolati in tempo reale usando un adeguato software composto di GPU che consente ai medici di rivedere l’intero volume mammario sui tre piani. L’operatore segnala all’apparecchiatura la posizione del capezzolo come punto di riferimento su tutte le viste acquisite per consentire il corretto orientamento e le ricostruzioni di post- elaborazione, poi si procede ad una valutazione qualitativa dell’esame.
Rispetto alla sola mammografia, l’imaging di ABUS osserva in modo diverso il tessuto mammario denso, fornendo una visione completa del seno.
Lo screening con ABUS supplementare alla mammografia ha permesso un aumento relativo del 37% nel rilevamento del cancro in generale rispetto alla sola mammografia e un aumento relativo dell’identificazione dei tumori al seno invasivi nel tessuto mammario denso del 55%. [11]
L’imaging supplementare alla mammografia con ABUS trasforma la cura del seno da reattiva a proattiva. Numerosi studi di ricerca clinica dimostrano che quando ABUS è usato in aggiunta alla mammografia, i piccoli tumori rilevati solo attraverso l’ABUS sono risultati prevalentemente invasivi e con linfonodi negativi, rilevando i tumori in una fase più precoce e curabile. [12] Questo ha importanti implicazioni prognostiche e può ridurre il costo delle cure. Quando i tumori al seno si trovano allo stadio 1 e 2, il 70% dei pazienti può evitare la chemioterapia. [13]
Gli studi clinici hanno confermato la stadiazione accurata, economica e non invasiva dei tumori al seno prima dell’intervento chirurgico grazie all’acquisizione del piano coronale che rappresenta una visione intera e completa del tessuto mammario. Questa prospettiva globale mostra chiaramente distorsioni architettoniche e malattie multifocali.
Poiché sul piano coronale la mammella è vista come sul tavolo operatorio, questo piano è noto come piano chirurgico. Questa vista migliora la valutazione dei bordi delle lesioni. Le lesioni benigne sono spesso circondate da un bordo iperecogeno continuo, mentre le lesioni maligne presentano spesso un bordo iperecogeno discontinuo. [14] Inoltre, in questo piano, i tumori sono riconosciuti come “ black holes ”, frequentemente associati ad un fenomeno di retrazione rappresentato dall’infiltrazione tumorale e dalla reazione desmoplastica del tessuto circostante contro il tumore maligno, presentandosi come linee rette iperecogene che si irradiano dalla superficie della massa. Sul piano coronale le spiculazioni dovute alla reazione desmoplastica sono più evidenti che sul piano assiale, presentandosi come linee rette iperecogene che si irradiano dalla superficie della massa .
Zelst et al. [15] hanno trovato una correlazione positiva tra un ” indice del fenomeno di spiculazione e retrazione ” valutato nel piano coronale e la probabilità di cancro. Il fenomeno della retrazione è correlato statisticamente con dimensioni del tumore più piccole, grado istologico inferiore e stato positivo dei recettori per estrogeni e progesterone. Il piano coronale consente la ricostruzione del sistema duttale dell’intera mammella, che facilita l’individuazione della dilatazione duttale associata a lesioni papillari intraduttali, o anche del carcinoma duttale in situ, rilevando echi intraluminali nei dotti lattiferi dilatati. Inoltre, ABUS ha mostrato risultati promettenti per la valutazione preoperatoria dell’estensione del tumore, essendo addirittura superiore all’HHUS.
La tecnologia di ABUS fornisce immagini riproducibili per la posizione della lesione mammaria, la misurazione delle dimensioni e la caratterizzazione, che si sono rivelate utili, specialmente in situazioni cliniche che richiedono l’imaging di follow-up. La variazione della pressione di scansione può influenzare la profondità e le caratteristiche della lesione. Inoltre, le ricostruzioni coronali portano nuove informazioni diagnostiche.
Rispetto alla HHUS , che viene eseguita dai medici e richiede 20 min per paziente, il tempo che il radiologo impiega in ABUS è legato solo alla valutazione delle immagini perché l’acquisizione è effettuata dal tecnico. Grazie a questo vantaggio, ABUS può essere utilizzato come strumento alternativo nello screening delle donne con seno denso per migliorare il flusso di lavoro. Infatti, ABUS sembra adatto a sostituire HHUS nelle donne richiamate per un risultato sospetto sulla mammografia di screening.
Inoltre, in alcuni studi [16] sono stati confrontati l’ABUS e l’HHUS come metodi di second-look per la valutazione di pazienti sottoposti a risonanza magnetica preoperatoria e per la valutazione della risposta alla chemioterapia neoadiuvante, in cui si è riscontrato che i metodi erano comparabili in termini di tasso di rilevamento.
La chemioterapia neoadiuvante è un concetto terapeutico ampiamente accettato nel trattamento del cancro al seno. Il monitoraggio della risposta precoce alla chemioterapia neoadiuvante è un elemento chiave per il successo del trattamento e l’ABUS è uno strumento molto promettente, con il suo comportamento riproducibile, standardizzato e non invasivo per supportare il processo di monitoraggio , nonché per il monitoraggio intermedio per consentire una terapia personalizzata. Diverse pubblicazioni hanno mostrato un’elevata
Nel caso in cui il trasduttore non sia uniformemente e sufficientemente compresso , l’aria si interpone ai bordi dell’immagine acquisita, ostacolando l’analisi del parenchima ghiandolare alla periferia dell’immagine. Una compressione insufficiente può anche causare artefatti indotti dai legamenti di Cooper, un artefatto riscontrato anche in caso di compressione insufficiente all’HHUS. Per ridurre questo artefatto, il tecnico di radiologia deve eseguire una compressione adeguata.
Se lo scorrimento del trasduttore sulla superficie cutanea non è uniforme a causa di una lozione insufficiente, è possibile vedere artefatti di movimento della sonda. Gli “ artefatti di bordo ” sono visti come ipoecogenicità localizzate sul lato del campo di scansione assiale, orientate verticalmente alla superficie della pelle non corrispondenti a una cicatrice e che non persistono su acquisizione laterale dedicata.
Tempi di scansione considerevoli (circa 60 secondi per volume) spesso provocano artefatti respiratori: il respiro profondo o rapido provoca l’oscillazione della parete toracica e produce distorsioni ondulatorie note anche come artefatti di ondulazione (16).
Quando il trasduttore scivola rapidamente su una lesione solida e superficiale (ad es. un fibroadenoma o una cisti), crea un artefatto lineare (“ skip artifact ”), che si osserva sul piano coronale e sul piano sagittale. Appare come una linea orizzontale situata sopra la lesione (Figura 10), come un segno di taglio tra la lesione e il tessuto mammario circostante.
Le valutazioni delle regioni retroareolari possono essere difficili a causa di un artefatto di ombreggiatura indotto dal capezzolo che si presenta come colonne ipoecogene che si estendono in direzione antero-posteriore dietro il capezzolo. Questo artefatto può essere causato da una regolazione imperfetta della superficie irregolare del capezzolo e, se si sospetta un’anomalia, il paziente viene richiamato per una nuova scansione o per una HHUS. (Figura 10) Tale artefatto può essere evitato attraverso uno stretto contatto tra il capezzolo e la scatola di scansione.
L’edema post-traumatico o post-terapeutico, o da mastite infettiva o carcinomatosa, provoca la comparsa di aree di attenuazione diffusa all’interno del parenchima ghiandolare. L’artefatto “ white wall sign ” si osserva con masse transoniche (cisti) o alcune masse solide come in HHUS; si presenta come una parete ecogena nella vista coronale e corrisponde al miglioramento acustico su HHUS. Appare posteriormente alla lesione a causa di ultrasuoni meno attenuati all’interno della lesione. Può aiutare l’interpretazione, ma non è specifico per le masse benigne a causa del fatto che anche i carcinomi di alto grado possono presentare questo artefatto.
Le patologie che possono rappresentare cause di falsi positivi sono l’adenosi, il papilloma intraduttale, il fibroadenoma o la mastite [12]. Le immagini ABUS sono immagini in sezione e statiche. Questa peculiarità tecnica apre la possibilità di ottenere risultati falsi positivi in cisti complicate che mimano lesioni cistiche complesse. In queste situazioni, l’HHUS può ovviare in tempo reale al fatto che l’aspetto intracistico è prodotto solo da echi fluttuanti. Piccole lesioni, bordi circoscritti (come nel carcinoma midollare, nei tumori filloidi o nel carcinoma papillare solido invasivo) o la localizzazione periferica della massa possono essere fonti di risultati falsi negativi [12].
La rimozione o la riduzione significativa degli artefatti e l’abbassamento dei risultati falsi positivi o negativi possono essere ottenuti attraverso un rigoroso addestramento dei tecnici di radiologia per rispettare il posizionamento del paziente, un appropriato contatto trasduttore-pelle, un uso adeguato della lozione e una scansione completa del tessuto ghiandolare nelle regioni periferiche, soprattutto dei seni più grandi. Inoltre, i medici dovrebbero avere informazioni relative alla storia dei pazienti e dati clinici o anche esami precedenti per il confronto. [21]
Inoltre, l’ottimizzazione della pressione di scansione è necessaria per ottenere un’elevata riproducibilità dei dati, tuttavia, non ci sono studi che riportino dati conclusivi sulla pressione di compressione ottimale. Kim et al. [22] ha inoltre proposto l’uso di un cuscinetto di gel specifico posto sul seno per ridurre il dolore a causa della pressione di scansione ed evitare artefatti di difetto di contatto. Ciò consente anche di espandere l’area scansionata. Sono stati sviluppati sistemi automatizzati per la valutazione della qualità delle immagini ABUS, per avvertire gli operatori della comparsa di artefatti più comuni durante l’acquisizione delle immagini. Ciò potrebbe richiedere la ripetizione immediata delle scansioni [23].
Il numero di immagini a disposizione è estremamente dipendente dal numero di esami effettuati nel rispettivo ospedale, non sempre è possibile accedere a immagini ABUS di esami effettuati in altri ospedali o cliniche private. Inoltre bisogna tenere conto anche del modello del macchinario, che potrebbe differire da quello del proprio ospedale di riferimento, aggiungendo ulteriore complessità allo sviluppo del sistema CAD a causa dell’integrazione di immagini provenienti da diversi dispositivi.
Attualmente, negli Stati Uniti esiste un solo sistema ecografico per lo screening del carcinoma mammario in aggiunta alla mammografia per donne asintomatiche con tessuto mammario denso. Questo sistema, Automated Breast Ultrasound (ABUS) (acquisito da GE Healthcare) ha apportato miglioramenti significativi nella visualizzazione del tumore nei seni densi.
“La mammografia è uno strumento efficace per diagnosticare il cancro al seno, ma non funziona altrettanto bene in tutte”, ha osservato Rachel F. Brem, MD, Direttore, Centro di imaging mammario e interventista, Professore di Radiologia, Vicepresidente, Ricerca e Sviluppo della Facoltà , The George Washington University Medical Center, Washington, DC. Il Dr. Brem è stato il principale ricercatore dello studio clinico SOMO-INSIGHT che ha esaminato se la mammografia digitale a pieno campo e l’Abus potessero migliorare il rilevamento del carcinoma mammario rispetto alla sola mammografia nelle donne con seno denso.
“Negli studi recentemente completati, dimostrati con l’aggiunta di ABUS, troviamo circa il 30% in più di tumori nelle donne che hanno una mammografia normale, un normale esame clinico e un seno denso. Per il> 40% delle donne che hanno un seno denso, questo è un progresso significativo nella diagnostica del seno “, ha affermato la Dott.ssa Brem. Ha infine aggiunto, “ABUS risolve il problema di come trovare il cancro nei seni densi e in una fase precoce.”
Con l’adozione di una nuova legislazione sulla densità del seno a livello nazionale, un numero crescente di donne con seni densi richiederà esami ecografici oltre alla mammografia. La sfida è come ottimizzare il processo. La procedura standard oggi prevede l’uso di ultrasuoni portatili, che sono molto dipendenti dall’operatore. Comparativamente, i sistemi automatici di ecografia mammaria si prestano meglio all’ambiente di screening, secondo la Dr. Brem.
Con ABUS, lo scanner è posizionato sul seno e il tecnico preme un pulsante per iniziare un’ecografia tridimensionale (3D), anteriore, esterno e interno del seno. Siemens Healthcare offre anche un sistema di ultrasuoni automatizzato, l’ACUSON S2000 ™ Automated Breast Volume Scanner (ABVS).
In un nuovo studio, Marcela Böhm-Vélez, MD, di Weinstein Imaging Associates a Pittsburgh, PA, e Ellen B. Mendelson, MD, un radiologo diagnostico presso il Northwestern Memorial Hospital di Chicago, IL, stanno utilizzando l’ABVS per lo screening e il confronto della mano tenuto con ultrasuoni mammari automatizzati. L’obiettivo dello studio è quello di mostrare che possono rilevare un maggior numero di lesioni con il sistema ABVS come con gli ultrasuoni portatili.
“Con il 40% -50% della popolazione con seni densi, non ci sono abbastanza ecografisti addestrati a disposizione per eseguire l’ecografia del seno per tutte queste donne. Ecco perché gli ulttrasuoni con scansioni manuali sarebbero una buona opzione per lo screening di tutte queste donne con seni densi senza richiedere che un tecnologo lo faccia “, ha detto Böhm-Vélez. “Ci auguriamo che questa tecnologia possa sostituire gli ultrasuoni portatili, soprattutto per i pazienti sottoposti a screening”.
Un’altra caratteristica importante di ABVS è la vista coronale aggiuntiva. “La tecnologia ABVS fornisce la vista coronale, che non possiamo vedere con l’ultrasuono palmare, e la vista coronale mostra meglio la trazione dei legamenti di Cooper, che è un segno indiretto che potrebbe esserci un cancro lì”, ha detto Böhm- Vélez. “Dato che hai una ricostruzione 3D, puoi guardare le immagini da qualsiasi vista – coronale, trasversale, longitudinale, qualunque cosa tu voglia – invece di guardare le immagini statiche 2D con gli ultrasuoni manuali”. Ha aggiunto: “Penso che per un ampio programma di screening, c’è un ruolo per questa tecnologia, in particolare per le donne con seno denso”.
ABUS viene utilizzato come modalità aggiuntiva alla mammografia per ridurre l’incidenza di falsi negativi. Diversi studi hanno dimostrato che ABUS identifica sino a 7 tumori mammari allo stadio iniziale di sviluppo ogni 1000 donne esaminate; tumori non visualizzabili con la sola mammografia. L’abbinamento di Mammografia 3D, ABUS 3D ed Ecografia 2D con eventuale Elastografia, rappresenta le massime possibilità diagnostiche offerte dalla tecnologia. Nelle donne di età inferiore a 40 anni, ABUS è indicato come esame preliminare all’Ecografia 2D per identificare le deformazioni tessutali espressione di tumori in fase iniziale. Va sottolineato che nelle varie modalità di applicazione clinica, ABUS si è dimostrata in grado di individuare un numero elevato di lesioni tumorali ad uno stadio più precoce, quando i linfonodi non erano interessati, aumentando di conseguenza le possibilità di trattamento.

Imaging optoacustico: una nuova angolazione sugli ultrasuoni
Un nuovo approccio all’ecografia è la tecnologia di imaging optoacustico, progettata per migliorare la precisione. La tecnologia di imaging optoacustico combina l’imaging ottico con gli ultrasuoni per fornire mappe del sangue del corpo. Utilizza impulsi molto brevi di luce laser diretta alla regione di interesse, che vengono convertiti in un’immagine in tempo reale. I colori (lunghezze d’onda) degli impulsi luminosi sono scelti in base alla loro capacità di essere assorbiti preferenzialmente sia dal sangue ossigenato che dal sangue deossigenato. Le onde acustiche che risultano dall’assorbimento della luce viaggiano verso i trasduttori. Utilizzando questa matrice di trasduttori, è possibile ricostruire le immagini 2D.
“La differenza di frequenza che l’onda ultrasonica restituisce dipende dalle caratteristiche di quel tessuto. Quando il tessuto ha il cancro, uno dei segni distintivi del cancro è che non regola bene il flusso sanguigno perché consuma grandi quantità di ossigeno “, ha spiegato Mike Ulissey, MD, consulente medico di Seno Medical Instruments Inc., San Antonio, TX .
“Usando la luce laser a frequenze diverse, possiamo anche co-registrarla con l’imaging ad ultrasuoni in modo che il radiologo possa osservare la lesione e identificarne la posizione, e utilizzare la lunghezza d’onda del laser da imaging opto-acustico per analizzare quella specifica massa o regione di preoccupazione. Con gli ultrasuoni, guarda alle informazioni strutturali, valutando la morfologia della lesione ai margini “.
L’imaging optoacustico può essere utilizzato non solo per il rilevamento del cancro ma anche per analizzare un nodulo al seno potenzialmente sospetto.
“Mentre l’imaging optoacustico è una tecnologia funzionale, è simile alla spettroscopia RM e alla tomografia ad emissione di positroni / tomografia computerizzata (PET / CT) in quanto fornisce dati funzionali e anatomici con un livello di accuratezza simile. Tuttavia, prevediamo che sarà meno costoso e non userà radiazioni, radioisotopi e agenti di contrasto “, ha detto il dott. Ulissey.
Imaging in modalità combinata con tomosintesi e mammografia spettrale a contrasto
Due ulteriori sviluppi della mammografia digitale sono stati recentemente introdotti nella pratica clinica: tomosintesi e CESM. Entrambe le tecniche sono destinate a superare alcune limiti della mammografia riducendo gli effetti di somma (tomosintesi) o aumentando le differenze di contrasto (CESM), soprattutto, ma non solo, nelle donne con tessuto mammario denso. In queste donne, i tumori possono essere mascherati a causa della sovrapposizione del tessuto mammario e dalla mancanza di contrasto del tessuto mammario normale adiacente. Finora, queste tecniche sono state proposte principalmente come complemento alla mammografia nelle donne con scoperte inconcludenti nei loro mammografie iniziali, con risultati interessanti. La tomosintesi è stata anche valutata positivamente come strumento di screening.
La mammografia 3D con mezzo di contrasto, CESM ( contrast enhanced spectral mammography)
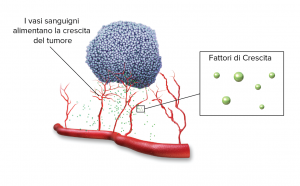
L’utilizzo di mezzo di contrasto permette di evidenziare la proliferazione di vasi in prossimità del tumore (come in risonanza magnetica). Non a caso le masse tumorali sono in genere più ricche di vasi di un tessuto normale. Questo fenomeno è noto col nome di angiogenesi, cioè formazione di vasi.
Angiogenesi significa letteralmente la creazione di nuovi vasi sanguigni. La formazione di nuovi vasi all’interno del tumore da altri pre-esistenti (angiogenesi) garantisce l’apporto di ossigeno e nutrienti, come pure l’eliminazione di metaboliti, senza i quali la crescita tumorale sarebbe bilanciata dalla necrosi del tumore. I vasi sanguigni costituiscono il veicolo tramite il quale l’ossigeno e i vari nutrienti raggiungono i tessuti. L’angiogenesi è un processo multifasico, che promuove la formazione di nuovi vasi sanguigni dalla rete vascolare preesistente. Tale fenomeno prevede l’attivazione, la proliferazione e la migrazione di cellule endoteliali (EC), la distruzione della membrana basale vascolare, il rimodellamento della matrice extracellulare dei tessuti, la formazione di vasi e di una rete vascolare, il reclutamento di cellule di supporto, come le cellule muscolari lisce e i periciti e, infine, la connessione con il network vascolare preesistente.
 Per essere in grado di mostrare l’acquisizione del contrasto tumorale in un’immagine mammografica, è necessario acquisire due esposizioni del seno, ciascuna con una diversa composizione energetica a raggi x, una possibilità tecnica disponibile per alcuni nuovi mammografia unità. Questo produce un’immagine a bassa energia, identica ad un mammografia normale, e un’immagine ad alta energia dalla sottrazione delle due immagini si ottengono informazioni sulla distribuzione del contrasto nel seno; contenente informazioni sulla distribuzione del contrasto nel seno; l’uso di energie diverse è la ragione della denominazione mammografia spettrale. A seconda della composizione e dello spessore del seno, questo provoca una dose di radiazioni supplementare di circa il 20%, ma entrambe le immagini insieme implicano una dose a raggi x al di sotto della dose raccomandata per la mammografia [ 30 , 31 , 32 , 33 ].
Per essere in grado di mostrare l’acquisizione del contrasto tumorale in un’immagine mammografica, è necessario acquisire due esposizioni del seno, ciascuna con una diversa composizione energetica a raggi x, una possibilità tecnica disponibile per alcuni nuovi mammografia unità. Questo produce un’immagine a bassa energia, identica ad un mammografia normale, e un’immagine ad alta energia dalla sottrazione delle due immagini si ottengono informazioni sulla distribuzione del contrasto nel seno; contenente informazioni sulla distribuzione del contrasto nel seno; l’uso di energie diverse è la ragione della denominazione mammografia spettrale. A seconda della composizione e dello spessore del seno, questo provoca una dose di radiazioni supplementare di circa il 20%, ma entrambe le immagini insieme implicano una dose a raggi x al di sotto della dose raccomandata per la mammografia [ 30 , 31 , 32 , 33 ].
Sulla base di risultati ancora preliminari, la CESM può essere considerata come un’alternativa alla Risonanza con contrast-enhanced in caso vi siano controindicazioni alla Rm (inclusa la presenza di dispositivi non sicuri nel corpo del paziente, claustrofobia e obesità che impediscono al paziente di praticare la risonanza) o controindicazioni ad iniezione di contrasto a base di gadolinium o a causa di condizioni locali di difficoltà ad eseguire la risonanza.
Nota: è importante notare che gli agenti contrastanti iodati vengono spesso utilizzati nella pratica clinica, per lo più iniettati per via endovenosa per la tomografia. Ci sono controindicazioni (storia di reazioni allergiche, insufficienza renale) per i possibili effetti collaterali che richiedono discussione con il paziente e la firma di un consenso scritto. Quindi, l’iniezione di agenti di contrasto iodati per la mammografia richiede le stesse precauzioni utilizzate per altri esami basati sul contrasto. Prima dell’esame, il radiologo chiarirà i rischi e i benefici associati all’iniezione endovenosa di agenti contrastanti. La combinazione delle due immagini con un software dedicato consente di ottenere una nuova immagine in cui è facilmente riconoscibile la presenza di contrasto.
E’ una nuova tecnica diagnostica che prevede l’iniezione venosa di mezzo di contrasto iodato e l’acquisizione in rapida sequenza di una coppia di immagini a bassa e ad alta energia e dalla successiva “sottrazione” delle due immagini si ottiene una visualizzazione del contrasto. viene somministrato per via endovenosa e successivamente viene eseguita una mammografia a doppia energia.
Si tentò inizialmente una strategia basata sulla sottrazione temporale (come in RM) di immagini ad alta energia la sottrazione temporale è stata abbandonata: la sottrazione temporale è stata abbandonata ela compressione della mammella di lunga durata abbandonata perchè:
- non confortevole per la paziente
- artefatti da movimento
- la compressione può ostacolare la normale perfusione del mezzo di contrasto
- esame monolaterale
La strategia oggi utilizzata (CESM) prevede l’acquisizione in rapida sequenza di una coppia di immagini a bassa ed alta energia dalla “sottrazione” delle due immagini si ottiene una visualizzazione del contrasto. In mammografia lo spettro X ha energie tipicamente con questa energia l’impregnazione di iodio ha un contrasto modesto. La CESM utilizza un fascio di energia superiore al k edge dello iodio (33 keV) per aumentare il contrasto la strategia è usare un fascio di alta energia fortemente filtrato per aumentare la componente di energia maggiore del k-edge dello iodio, aumentando il contrasto delle regioni impregnate di mdc e riducendo la dose alla paziente.
Trova applicazione nell’analisi vascolare dei noduli mammari sospetti scoperti con Ecografia e Mammografia: i noduli maligni, infatti, tendono a crescere e diventare più grandi in quanto alimentati dal flusso sanguigno. Viene inoltre indicata nelle pazienti con carcinoma accertato, in fase pre-chirurgica ai fini di stabilire se il focolaio è unico o multiplo, in chi è sottoposto a chemioterapia prima dell’intervento e nelle situazioni in cui la Risonanza Magnetica risulti non eseguibile.
La Mammografia con Mezzo di Contrasto (CEM) fornisce informazioni aggiuntive rispetto alla semplice mammografia che possono migliorare la capacità di rilevare lesioni. La mammografia con Mezzo di Contrasto (CEM) risulta ad oggi un esame totalmente affidabile, con una sensibilità paragonabile alla Risonanza Magnetica (MRI), ma con una specificità superiore 1, 2, 3. La Mammografia con Mezzo di Contrasto permette la visualizzazione di un farmaco, noto come mezzo di contrasto, la cui presenza é evidenziata nelle aree dove si sviluppano le lesioni erogando in rapida sequenza Raggi X a bassa e ad alta energia. I mezzi di contrasto usati sono gli stessi normalmente usati durante gli esami TAC.
Grazie all’ultimo aggiornamento recentemente introdotto, si ottengono immagini funzionali ancora più nitide grazie a dedicati processing di riduzione degli artefatti da sottrazione ed attenuazione del BPE (Background Parenchymal Enhancement).
La Mammografia con Contrasto, è caratterizzata da:
- Possibilità di procedure di reperaggio con metodica dual energy
- Co-registrazione con la mammografia 2D-3D con medesima compressione
- Velocità di esecuzione
- Semplicità della procedura
- Ridotta dose
- Qualità immagine aumentata, con riduzione del BPE ed artefatti
RIFERIMENTI
- A Petrillo, R Fusco, P Vallone, et al. Digital breast tomosynthesis and contrast‐enhanced dual‐energy digital mammography alone and in combination compared to 2D digital synthetized mammography and MR imaging in breast cancer detection and classification. The Breast, 2020 – Elsevier
- Bicchierai, P. Tonelli, A. Piacenti, et al. Evaluation of contrast‐enhanced digital mammography (CEDM) in the preoperative staging of breast cancer: Large‐scale single‐center experience. The Breast Journal, 2020 – Wiley Online Library
- Fallenberg EM, Schmitzberger FF, Amer H, et al. Contrast-enhanced spectral mammography vs. mammography and MRI – clinical performance in a multi-reader evaluation. European Radiology 2017 – Springer
Sulla base di risultati ancora preliminari, CESM può essere considerato come un’alternativa alla MRI contrast-enhanced in caso di controindicazioni a MRI (inclusa la presenza di dispositivi MRI-non sicuri nel corpo del paziente, claustrofobia e obesità che impediscono al paziente di entrare nel magnetica) o ad iniezione di contrasto a base di gadolinium e condizioni locali di difficoltà di MRI [ 9 , 10 ] a causa di risultati interessanti ottenendo confrontando CESM e MRI negli stessi pazienti [ 37 , 38 ]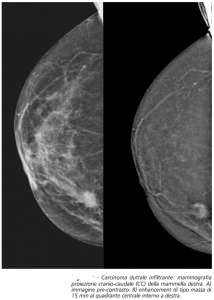 Sulla base di risultati ancora preliminari, CESM può essere considerato come un’alternativa alla MRI contrast-enhanced in caso di controindicazioni a MRI (inclusa la presenza di dispositivi MRI-non sicuri nel corpo del paziente, claustrofobia e obesità che impediscono al paziente di entrare nel magnetica) o ad iniezione di contrasto a base di gadolinium e condizioni locali di difficoltà di MRI [ 9 , 10 ] a causa di risultati interessanti ottenendo confrontando CESM e MRI negli stessi pazienti [ 37 , 38 ].
Sulla base di risultati ancora preliminari, CESM può essere considerato come un’alternativa alla MRI contrast-enhanced in caso di controindicazioni a MRI (inclusa la presenza di dispositivi MRI-non sicuri nel corpo del paziente, claustrofobia e obesità che impediscono al paziente di entrare nel magnetica) o ad iniezione di contrasto a base di gadolinium e condizioni locali di difficoltà di MRI [ 9 , 10 ] a causa di risultati interessanti ottenendo confrontando CESM e MRI negli stessi pazienti [ 37 , 38 ].
Nota J. È importante notare che gli agenti contrastanti iodati vengono spesso utilizzati nella pratica clinica, per lo più iniettati per via endovenosa per la tomografia computazionale. Ci sono controindicazioni (storia di reazioni allergiche, insufficienza renale) e possibili effetti collaterali che richiedono discussione con il paziente e la firma di un consenso scritto. Quindi, l’iniezione di agenti di contrasto iodati per la mammografia richiede le stesse precauzioni utilizzate per altri esami a raggi-contrast basati sul contrasto [ 39 , 40 ]. Prima dell’esame, il radiologo chiarirà i rischi ei benefici associati all’iniezione endovenosa di agenti contrastanti iodati.
Qual’ è il ruolo delle nuove tecnologie come la tomosintesi e la CESM?
Il ruolo di queste nuove tecnologie è quello di aiutare nella rilevazione e nella diagnostica dei tumori al seno. La Tomosintesi è comunemente accettata come uno strumento efficace per la valutazione dei pazienti sintomatici e risultati sospetti durante la mammografia di screening. Studi sullo screening hanno dimostrato che la tomosintesi permette di identificare più tumori rispetto alla mammografia e potenzialmente riduce il numero di donne richiamate per risultati benigni. Finora, la CESM è stato valutata in un numero limitato di piccoli studi. Fornisce informazioni utili sulle lesioni sospette, aumentando la visibilità delle lesioni maligne, in particolare nelle donne con seni densi e può essere un’alternativa alla RM in contrasto, in particolare nel caso di controindicazioni a MRI o ad iniezione di contrasto a base di gadolinium così come di difficile disponibilità di MRI.
Allec ed altri (2011) hanno osservato che l’accumulo di agenti di contrasto iniettati consente l’aumento delle immagini delle lesioni attraverso l’uso di mammografia a contrasto. In questa tecnica, la combinazione di 2 immagini acquisite viene utilizzata per creare un’immagine migliorata. Esistono diversi metodi per acquisire le immagini da unire, che comprendono la sottrazione di doppia energia usando un solo livello di rilevazione che soffre di manufatti di movimento a causa del movimento del paziente tra l’acquisizione di immagini. Per mitigare gli artefatti di movimento, è possibile utilizzare un rivelatore composto da 2 strati per acquisire simultaneamente le immagini a basso e ad alta energia. In questo lavoro, questi ricercatori hanno valutato entrambi questi metodi usando il selenio amorfo come materiale di rilevazione per trovare i parametri di sistema (tensione del tubo, filtrazione, spessore del fotoconduttore e rapporto di intensità relativa) che portano alla prestazione ottimale. Quindi hanno confrontato le prestazioni dei 2 rilevatori sotto la variazione della concentrazione dell’agente di contrasto, delle dimensioni del tumore e della dose. La rilevabilità è risultata essere più comparabile all’estremità inferiore dei fattori valutati. Il rivelatore monostrato non solo ha portato a un migliore contrasto, grazie alle sue maggiori capacità di separazione spettrale, ma ha anche minato il rumore quantico. Il rivelatore a singolo strato è stato trovato per avere una maggiore rilevabilità per un fattore di 2,4 per un tumore a raggio di 2,5 mm avente una concentrazione di agenti di contrasto di 1,5 mg ml (-1) in un seno ghiandolare del 50% di spessore di 4,5 cm. Gli autori hanno affermato che l’inclusione di manufatti di movimento nel confronto è parte degli sforzi di ricerca in corso.
Zhao ed altri (2012) hanno osservato che la mammografia è lo strumento primario di screening per la diagnosi e la diagnosi di tumori al seno umano, ma circa 10-20% dei tumori palpabili non sono rilevabili sui mammografie e solo circa il 40% delle lesioni biopsie sono maligne. Questi ricercatori hanno riferito un metodo tomografico a raggi X a basso dosaggio ad alta risoluzione per la diagnosi 3D di tumori al seno umano. Combinando l’imaging a raggi X a contrasto di fase con un metodo di ricostruzione dell’immagine conosciuto come tomografia altrettanto inclinata, questi investigatori hanno immaginato un seno umano in 3D e individuato un cancro maligno con una dimensione del pixel di 92 μm e una dose di radiazione inferiore a quella di doppia vista mammografia. Secondo una valutazione cieca da 5 radiologi indipendenti, questo metodo può ridurre la dose di radiazioni e il tempo di acquisizione di circa il 74% rispetto alla tomografia a raggi X convenzionali a contrasto di fase, pur mantenendo elevata risoluzione di immagine e contrasto dell’immagine. Gli autori hanno concluso che questi risultati hanno dimostrato che l’imaging diagnostico 3D ad alta risoluzione di tumori al seno umano può in linea di principio essere eseguito a dosi cliniche compatibili.
Inoltre, una revisione UpToDate sulla “MRI del seno e le tecnologie emergenti” (Slanetz, 2013) afferma che “la tecnologia di imaging emergente per la rilevazione del cancro di Breasr – il riconoscimento delle limitazioni della mammografia, dell’ecografia e della MRI del seno ha portato ad indagine di altre tecniche di imaging del seno, tra cui la mammografia digitale a doppio effetto energetico a contrasto, la risonanza magnetica ad alta campo, la spettroscopia a risonanza magnetica, l’imaging ponderato sulla diffusione, l’imaging gamma specifico del seno e la mammografia a emissione di positroni “. La mammografia spettrale migliorata di contrasto non è menzionata in questa recensione.
Luczyiska ed altri (2015) hanno confrontato la mammografia spettrale migliorata del contrasto (CESM) e la MRI del seno con i risultati istopatologici e confrontata la sensibilità, l’esattezza e valori predittivi positivi e negativi per entrambe le modalità di imaging. Dopo l’approvazione dell’etica, sono stati eseguiti esami CESM e MRI in 102 pazienti che presentavano lesioni sospette descritte nella mammografia convenzionale. Tutte le lesioni visibili sono state valutate in modo indipendente da due radiologi esperti che utilizzano classificazioni BI-RADS (scala da 1 a 5). Le dimensioni delle lesioni misurate con ciascuna modalità sono state confrontate con i risultati di istopatologia post-operatoria. Ci sono stati 102 pazienti inseriti in studi CESM / MRI e 118 lesioni sono stati identificati dalla combinazione di CESM e MRI del seno.L’istopatologia ha confermato che 81 delle 118 lesioni erano maligne e 37 erano benigne. Delle 81 lesioni maligne, 72 erano tumori invasivi e 9 erano tumori in situ. La sensibilità è stata del 100% con CESM e il 93% con la MRI del seno. L’accuratezza è stata del 79% con il CESM e il 73% con la MRI del seno. Le aree di curva caratteristiche-operative riceventi basate su BI-RADS erano 0,83 per CESM e 0,84 per MRI del seno. Le stime della lesione sulla CESM e sulla MRI del seno erano simili, sia leggermente più grandi di quelle di istopatologia. Gli autori hanno concluso che questi risultati hanno indicato che CESM ha il potenziale di essere un prezioso metodo diagnostico che consente un’accurata rilevazione delle lesioni mammarie maligne, ha un elevato valore predittivo negativo e un tasso falso-positivo simile a quello della MRI del seno.
Hobbs ed altri (2015) hanno affermato che CESM può avere prestazioni diagnostiche simili a MRI a contrasto (CEMRI) nella diagnosi e nella messa a punto del cancro al seno. Ad oggi, la ricerca si è concentrata esclusivamente sulle prestazioni diagnostiche quando si confrontano queste due tecniche. L’esperienza del paziente è anche un fattore importante quando si confronta e decide su quale delle modalità è preferibile. Questi ricercatori hanno confrontato l’esperienza del paziente con CESM contro CEMRI durante la fase preoperatoria del cancro al seno. Un totale di 49 partecipanti che hanno subito CESM e CEMRI, come parte di un più ampio processo, hanno compilato un questionario Likert sulla loro preferenza per ogni modalità secondo i seguenti criteri: comfort della compressione del seno, comfort dell’iniezione di contrasto intravenoso (IV), ansia e preferenza generale. I partecipanti hanno anche riportato motivi per preferire una modalità all’altra. I dati quantitativi sono stati analizzati usando un test Wilcoxon sign-rank e test a chi-quadrato. I dati qualitativi sono stati riportati descrittivamente. È stata dimostrata una preferenza complessivamente maggiore rispetto al CESM (n = 49, p <0,001), con tempi di procedura più rapidi, maggiore comfort e minore rumore citati come motivi più comuni. I partecipanti hanno inoltre riportato significativamente più bassi tassi di ansia durante il CESM rispetto a CEMRI (n = 36, p = 0.009). Un tasso di comfort significativamente maggiore è stato segnalato durante la CEMRI per misure di compressione del seno (n = 49, p = 0.001) e la sensazione di iniezione a contrasto IV (n = 49, p = 0.003). Gli autori hanno concluso che questi dati suggerivano che i pazienti preferivano l’esperienza di CESM a CEMRI, aggiungendo il supporto al ruolo del CESM come possibile alternativa a CEMRI per la messa in scena del cancro al seno.
Inoltre, una revisione UpToDate su “La mammografia e l’ultrasuono” (Venkataraman e Slanetz, 2015) non menziona la mammografia spettrale migliorata in contrasto come opzione di gestione.
Fredenberg e colleghi (2010) hanno osservato che l’imaging spettrale è un metodo per la radiografia radiografica medica per estrarre informazioni sui componenti degli oggetti dalla dipendenza energetica specifica del materiale dell’attenuazione a raggi X. Gli autori hanno esaminato un sistema di immagini spettrali con conteggio di fotoni con 2 scomparti di energia per la mammografia a contrasto. Sono stati studiati l’ottimizzazione del sistema e il vantaggio potenziale rispetto alla convenzionale non-energia-risoluzione dell’immagine di assorbimento. È stato istituito un quadro per la caratterizzazione del sistema che includeva il rumore quantico e anatomico e un modello teorico del sistema è stato confrontato con le misurazioni fantasma. La combinazione ottimale delle immagini risolte dall’energia corrispondeva approssimativamente alla minimizzazione del rumore anatomico, comunemente indicato come sottrazione di energia. In tal caso, un indice di rilevabilità ideale-osservatore potrebbe essere migliorato vicino al 50% rispetto all’immagine di assorbimento nello studio fantasma. L’ottimizzazione rispetto al rapporto segnale / rumore-rumore, comunemente indicato come ponderazione energetica, ha consentito un miglioramento solo di un minuto. In una simulazione di un caso clinicamente più realistico, l’imaging spettrale è stato preveduto di eseguire circa il 30% migliore dell’immagine di assorbimento per un seno medio di glandularità con un livello medio di rumore anatomico. Per il tessuto mammario denso e un alto livello di rumore anatomico, tuttavia, è stato preveduto un aumento della rilevabilità di un fattore di 6. Un altro miglioramento del 70-90% è stato trovato in grado di raggiungere un sistema ottimizzato. Gli autori hanno concluso che la mammografia spettrale migliorata a contrasto è fattibile e vantaggiosa con l’attuale sistema, e c’è spazio per ulteriori miglioramenti. L’inclusione di rumore anatomico è essenziale per ottimizzare i sistemi di immagini a spettro.
Schmitzberger ed altri (2011) hanno dimostrato la fattibilità della tomosintesi di conteggio dei fotoni a bassa dose in combinazione con un agente di contrasto (mammografia tomografica migliorata con materiale a contrasto) per la differenziazione del cancro al seno. Tutti gli studi sono stati approvati dal consiglio di revisione istituzionale e tutti i pazienti hanno fornito un consenso informato scritto. È stato valutato un modello fantasma con pozzetti di materiale di contrasto iodato (3 mg di iodio per millilitro) di diametro 1, 2, 5, 10 e 15 mm. Sono stati inclusi complessivamente 9 pazienti con lesioni maligne e 1 con lesioni ad alto rischio (papilloma atipico) (tutte le donne, età media di 60,7 anni). È stato utilizzato un sistema di tomosintesi di conteggio a fotoni multipli (immagine spettrale) per produrre dati tomografici bassi e ad alta energia (rispettivamente sotto e sopra il bordo k di iodio), che consentivano la visualizzazione a doppia energia di iodio. Le immagini sono state ottenute prima dell’amministrazione del materiale di contrasto e 120 e 480 secondi dopo la somministrazione del materiale di contrasto. Quattro lettori hanno valutato indipendentemente le immagini insieme a mammografie convenzionali, immagini ultrasonografiche e immagini di risonanza magnetica. La dose ghiandolare è stata stimata. L’agente di contrasto è stato visibile nel modello fantasma con diametri di tumore sferico simulati di soli 5 mm. La dose ghiandolare media è stata misurata come 0.42 mGy per una completa scansione spettrale di tomosintesi di un seno. Poiché ci sono stati 3 punti di tempo (prima dell’amministrazione del mezzo di contrasto e 120 e 480 secondi dopo la somministrazione del mezzo di contrasto), ciò ha portato ad una dose totale di 1,26 mGy per tutta la procedura nel seno con l’anormalità. Sette di dieci casi sono stati classificati come il rapporto di rilevazione e dati del sistema di rilevazione del seno di 4 o superiore da tutti e quattro i lettori durante la revisione delle immagini spettrali in combinazione con i mammografi. Una lesione vicino alla parete toracica non è stata catturata sull’immagine spettrale a causa di un problema di posizionamento. Gli autori hanno concluso che l’uso di mammografia tomografica migliorata con contrasto è stato dimostrato con successo in pazienti con promettenti benefici diagnostici. Essi hanno affermato che ulteriori studi sono necessari per valutare appieno la sensibilità diagnostica e la specificità.
Ambicka e colleghi (2016) hanno osservato che CESM è una delle nuove modalità diagnostiche attuate nella pratica clinica. Nel caso di queste tecniche ci sono due importanti questioni da affrontare: (i) la loro utilità diagnostica, e (ii) la relazione tra parametri valutati usando queste tecniche e noti marcatori diagnostici / prognostici / predittivi (istologici, clinici, e molecolare). Pertanto, questi ricercatori hanno studiato la relazione tra il margine tumorale valutato su CESM e (i) i limiti tumorali definiti sulla base di esami macroscopici e microscopici, (ii) pT, (ii) pN e (iv) tumore in un gruppo di 82 pazienti con cancro al seno. Sulla base del CESM, il bordo tumorale è stato definito nitido, indistinto o speculato, mentre nel caso di lesioni che mostrano un miglioramento debole o medio su CESM i confini sono stati classificati come non specificati. Questi investigatori trovarono una relazione statisticamente significativa tra il margine tumorale su CESM e (i) la frontiera macroscopica (un margine spiccato sul CESM è stato trovato solo nei carcinomi con un confine invasivo per esame istologico; p = 0,004); (ii) pT (p = 0,016 ) e (iii) pN (coinvolgimento nodale è stato osservato più frequentemente nei carcinomi con un margine spettrale o indistinto sul CESM; p = 0,045). Inoltre, nei casi con un margine indefinito sul CESM (casi che mostrano un miglioramento debole o medio su CESM), entrambe le frontiere invasive e spinte sono state trovate nell’esame istologico. Gli autori hanno concluso che i risultati di questo studio preliminare hanno suggerito che è possibile valutare i confini macroscopici delle lesioni esaminate sulla base dell’immagine CESM. Questo potrebbe essere utile per pianificare la portata dell’escissione chirurgica. D’altra parte, la valutazione del margine tumorale sul CESM potrebbe non essere precisa nei casi che mostrano un debole miglioramento.
Kariyappa e colleghi (2016) il ruolo di mammografia spettrale a doppio-energia a contrasto (CEDM) come strumento di soluzione dei problemi in casi ambiziosi. Sono stati sottoposti a CEDM un totale di 44 donne con consenso equivoco sulle mammografie digitali a pieno campo. Tutte le immagini sono state interpretate da 2 radiologi indipendentemente. La fiducia della presenza è stata plottata su una scala di Likert a 3 punti e la probabilità di cancro è stata assegnata al punteggio di reporting e del sistema dati di Breast Imaging. L’istopatologia è stata considerata come il gold standard. Sono state eseguite analisi statistiche di tutte le variabili. Nello studio sono state inclusi complessivamente 44 lesioni al seno, tra le quali lesioni al 77,3% erano maligne o pre-cancerose e 22,7% lesioni erano benigne o inconcludenti; Il 20% delle lesioni è stato identificato solo sulla CEDM. La vera estensione della lesione è stata effettuata nel 15,9% dei casi, la multifocalità è stata stabilita nel 9,1% dei casi e l’estensione duttale è stata dimostrata nel 6,8% dei casi. Il significato statistico per CEDM era p <0,05; il valore di kappa inter-osservatore era di 0,837. Gli autori hanno osservato che il CEDM ha un ruolo utile nell’identificare lesioni occulte nei denti densi e nelle lesioni triaging. In una lesione mammograficamente visibile, CEDM caratterizza la lesione, afferma la ricerca e una migliore risposta dimostrata al trattamento. Hanno concluso che CEDM è un utile strumento complementare per il mammografia standard; ha la possibilità di essere una modalità di screening con la necessità di ulteriori studi e convalida.
Phillips e associati (2017) hanno valutato le preferenze del paziente verso la screening CESM contro MRI. Come parte di uno studio prospettico, i pazienti ad alto rischio presentavano la MRI del seno e la CESM. I pazienti hanno completato un’anonimata valutazione per valutare le preferenze relative alle 2 modalità; L’88% dei partecipanti ha completato l’indagine; Il 79% ha preferito CESM su MRI se gli esami avevano una sensibilità uguale; 89% sarebbe comodo ricevere il contrasto come parte di un test di screening annuale. Gli autori hanno concluso che le popolazioni ad alto rischio possono accettare CESM come esame di screening e possono preferire la screening di MRI se i trial in corso dimostrano che la screening CESM è clinicamente non inferiore a MRI.
Li e collaboratori (2017) retrospettivamente hanno confrontato le prestazioni diagnostiche di CESM con quelle del MRI del seno (BMRI) nel rilevamento del cancro al seno utilizzando parametri, compresa la sensibilità, PPV, dimensione lesione, morfologia, lesione e miglioramento della fase e tempo di esame. Sono stati inclusi complessivamente 48 donne (età media di 56 anni ± 10,6 [SD]) con lesioni del seno tra ottobre 2012 e marzo 2014. Sia CESM che BMRI sono stati eseguiti per ogni paziente entro 30 giorni. L’intensità di valorizzazione delle lesioni e del parenchima di base del seno è stata oggetto di valutazione soggettiva per entrambe le modalità ed è stata quantificata per il confronto. Il significato statistico è stato analizzato utilizzando t-test accoppiato per la dimensione media delle lesioni indice in tutti i seni maligni (una lesione indice definita come la lesione più grande in ciascun seno) e un punteggio medio di intensità di valorizzazione delle lesioni indice e del seno; PPV, sensibilità e accuratezza sono stati calcolati per CESM e BMRI. È stata inoltre confrontata la durata media di esami CESM e MRI. Sono state identificate 66 lesioni, di cui 62 lesioni maligne e 4 benigne. Sia CESM che BMRI hanno dimostrato una sensibilità del 100% per il rilevamento del cancro al seno. Non esisteva alcuna differenza statisticamente significativa tra la dimensione media delle lesioni indice (p = 0,108). L’intensità di valorizzazione dello sfondo del seno era significativamente inferiore per CESM che per BMRI (p <0.01). Il punteggio medio dell’intensità di valorizzazione delle lesioni di indice su CESM era significativamente inferiore a quello per BMRI (p <0.01). La più piccola lesione che è stata rilevata da entrambe le modalità misurate 4 mm; CESM aveva un PPV più elevato di BMRI (p> 0,05). Il tempo medio di esame per CESM era significativamente più breve di quello di BMRI (p <0.01). Gli autori hanno concluso che CESM aveva una sensibilità simile a quella del BMRI nel rilevamento del cancro al seno, con PPV più elevato e meno miglioramento della priorità bassa. Essi hanno affermato che CESM è associato ad un tempo di esame più breve, quindi un’alternativa più accessibile al BMRI e ha il potenziale per svolgere uno strumento importante nel rilevamento e nello stadio del cancro al seno.
Ruoli di risonanza magnetica al seno e MBI
La risonanza magnetica al seno è il gold standard per l’acquisizione di dati funzionali per pazienti ad alto rischio con seni densi e pazienti con una forte famiglia o storia genetica (geni BRCA1 o BRCA2) di patologia mammaria. Sebbene la risonanza magnetica al seno non sia una procedura di screening di routine, lo studio condotto dal Dr. Berg 5 ha rilevato che la RMN ha rilevato ulteriori cancri invasivi non osservabili in mammografia o ecografia.
Tuttavia, ci sono state critiche alla risonanza magnetica al seno per i suoi alti tassi di falsi positivi, con conseguente biopsie non necessarie, procedure chirurgiche e ansia per il paziente. “Quei tassi di falsi positivi sono più alti nei sistemi convenzionali di risonanza magnetica mammaria rispetto alle unità RM dedicate al seno”, ha detto Alan Hollingsworth, MD, direttore medico, chirurgo del seno al Mercy Women’s Center del Mercy Health Center, Oklahoma City, OK.
In un recente trial multicentrico, 8 gestito da ACR Image Metrix (l’organizzazione di ricerca clinica dell’American College of Radiology), il dott. Hollingsworth e altri ricercatori hanno scoperto che i sistemi RM dedicati alla mammella portavano a prestazioni diagnostiche migliori per sensibilità, specificità, valore predittivo negativo , valore predittivo positivo e area sotto la curva caratteristica operativa del ricevitore rispetto a quanto è stato riportato per l’imaging RM mammaria sui sistemi convenzionali di risonanza magnetica mammaria.
“I tassi di falsi positivi da studi precedentemente riportati utilizzando la risonanza magnetica del seno intero-corpo sono stati tipicamente tra il 30% al 50%. Il sistema dedicato alla risonanza magnetica al seno offre un significativo miglioramento delle prestazioni “, ha osservato il dott. Hollingsworth. “Anche all’interno dei 93 falsi positivi, il 27% erano istologici ad alto rischio, per i quali è spesso raccomandata l’escissione. 8 Questo tipo di prestazioni dovrebbe fornire allo stesso modo radiologi e chirurghi del seno con un livello più elevato di sicurezza diagnostica e potrebbe avere un impatto significativo sul ruolo della risonanza magnetica al seno. ”
Mentre la maggior parte dei sistemi di risonanza magnetica convenzionale ha bobine speciali per l’imaging del seno, c’è solo un dispositivo di risonanza magnetica approvato dalla FDA progettato specificamente per l’imaging del seno. L’unità è il sistema di risonanza magnetica mammaria dedicata 1,5T Aurora con spirale bilaterale DEDE, ed era il sistema di risonanza magnetica utilizzato nello studio. La bassa frequenza di risultati falsi positivi e falsi negativi associati a questo sistema dedicato di risonanza magnetica al seno può consentire l’uso di risonanza magnetica al seno con pazienti a basso rischio in entrambi gli ambienti di screening e diagnostici.
Dove si inserisce MBI?
Si chiama Molecular Breast Imaging (MBI) ed è una tecnica innovativa, nota anche come scintimammografia.
Con la diffusa disponibilità di risonanza magnetica al seno e di Cesm, molti radiologi potrebbero chiedersi dove si inserisca l’MBI. Proprio come la risonanza magnetica al seno, l’MBI è uno strumento che è un supplemento alla mammografia. Ma dove l’MBI è particolarmente utile in ambito clinico è per l’imaging di pazienti che non possono avere una risonanza magnetica o con seno marcatamente denso.
Questa nuova tecnica utilizza un tracciante radioattivo. Il tracciante viene iniettato nel corpo attraverso una vena del braccio. Le cellule del tumore al seno tendono ad assumere la sostanza radioattiva molto più che le cellule normali. Attraverso uno scanner di medicina nucleare si analizza il seno, alla ricerca di eventuali aree in cui si sia concentrata la sostanza radioattiva. In questo modo il tumore viene identificato più facilmente. Questa nuova tecnica usa come tracciante il fluorodeossiglucosio marcato, una sostanza radioattiva. In pratica, è come una Pet limitata alla mammella e che sembra essere più sensibile rispetto alla mammografia. una piccola quantità di tracciante radioattivo viene iniettata in una vena del braccio. Il tracciante si lega alle cellule del cancro al seno che possono essere rilevate utilizzando una telecamera che rileva la radiazione gamma rilasciata dal tracciante (gamma camera).
Per chi ha un tessuto mammario denso, la diagnosi è più difficoltosa. Il seno denso è una caratteristica anche della donna in menopausa e può essere dovuto alla terapia ormonale sostituiva.
Perché l’MBI è più efficace. In uno studio condotto presso la Mayo Clinic su 1600 donne con seno denso, due tumori sono stati diagnosticati con la sola mammografia, 14 con l’MBI e tre con entrambe le tecniche. Altri dati più recenti riguardano uno studio su 2600 donne. Sono stati diagnosticati 32 tumori al seno: 8 attraverso la classica mammografia e 29 con la tecnica MBI fatta insieme alla mammografia. In pratica, questo sistema di Imaging in associazione alla mammografia è risultato quattro volte più efficace nella diagnosi del cancro delle donne con seno denso.
Nello studio condotto dal Dr. Berg, 5 ha osservato, “La risonanza magnetica ha rilevato ulteriori cancri invasivi non osservati su mammografia o ecografia; tuttavia, abbiamo riscontrato che la risonanza magnetica era significativamente meno tollerabile rispetto alla mammografia o agli ultrasuoni per molti partecipanti allo studio. Dei partecipanti che hanno offerto una risonanza magnetica, solo il 58% ha accettato l’invito. ”
Allo stesso modo, per i pazienti del Karmanos Cancer Center di Detroit, MI, i problemi con la risonanza magnetica sono stati l’impulso per cercare una soluzione in termini di approccio multidisciplinare al cancro al seno. Per Sharon Helmer, MD, responsabile del servizio clinico, dipartimento di imaging e direttore, Breast Imaging, Karmanos Cancer Center, 2 scenari chiave l’hanno incoraggiata a prendere in considerazione l’MBI per lo screening dei suoi pazienti.
“Volevamo utilizzare un altro strumento per esaminare i loro seni con la RM per vedere oltre mammografia e ultrasuoni. Ma io pratico con una popolazione urbana con crescenti tassi di obesità, e abbiamo trovato un numero significativo di pazienti candidati alla risonanza magnetica, ma non potevamo avere risonanza magnetica per vari motivi: funzione renale, impianti o pacemaker, claustrofobia e problemi di peso ” ha spiegato il dottor Helmer. “Ci interessavano gli MBI perché circa il 20% dei nostri pazienti sono pazienti ad alto rischio con seno denso, che normalmente otterrebbero una biopsia e una RM per estensione della malattia”.
Mentre il centro ha un MR 3.0T dedicato, per un gran numero di pazienti, i medici non potrebbero fornire ai chirurghi ulteriori informazioni metaboliche per la pianificazione del trattamento. Pertanto, i medici del Karmanos Cancer Center hanno sostenuto MBI come soluzione e hanno implementato Discovery * NM750b, un’unità CZT a due teste di GE Healthcare. I rilevatori CZT si inseriscono in un dispositivo compatto, consentendo agli utenti di immaginare il seno da vicino, fino alla parete toracica. In uno studio recente, 9Confrontando le caratteristiche prestazionali della gamma gamma e della mammografia dedicate a due teste nelle donne con mammografia mammograficamente densa, i ricercatori hanno scoperto che l’aggiunta della gamma imaging alla mammografia ha aumentato significativamente il rilevamento del carcinoma mammario nodulo negativo nei seni densi di 7,5 su 1000 donne sottoposte a screening (95 % CI: 3,6, 15,4). Tuttavia, per essere clinicamente importante, la gamma imaging dovrà mostrare prestazioni equivalenti a dosi di radiazioni ridotte. Per quanto riguarda le radiazioni, il dott. Helmer sottolinea che i recenti protocolli a basse dosi sviluppati dalla Mayo Clinic hanno contribuito a condurre in sicurezza le procedure MBI.
“L’unità fornisce immagini ad alta risoluzione e grande funzionalità, ei pazienti sono davvero a proprio agio camminando in una stanza che assomiglia molto a un’unità mammografica. Inoltre, la compressione del seno è minima e le risposte dei pazienti sono state molto positive “, ha affermato Helmer.
Sia la risonanza magnetica che l’MBI sono indicati per i pazienti con un seno estremamente denso o con una storia familiare di cancro al seno. Secondo Dr. Helmer, la risonanza magnetica e l’MBI hanno funzioni molto simili. “MR ti offre squisiti dettagli anatomici, ma MBI cattura anche immagini chiare e precise, anche per quelli con tessuto mammario denso”, ha detto.
“Ovviamente, MR ti fornisce informazioni sul torace in aggiunta al fegato, che non possiamo ottenere con MBI. Come radiologo, guardi tutto il film. Non vedi l’intera estensione dei polmoni anteriori e della parte superiore del fegato che potresti includere nella valutazione su un MR. Se il paziente ha un carcinoma invasivo, il paziente verrà valutato e con TC e altri esami “, ha detto il dottor Helmer.
Ma uno dei vantaggi inaspettati di MBI è che è molto valido per il carcinoma lobulare. “Va bene perché spesso è difficile determinare l’esatta estensione della malattia di un carcinoma lobulare su mammografia ed ecografia. Tuttavia, a differenza della risonanza magnetica, l’MBI è sicuro per coloro che hanno pacemaker, protesi metalliche o altri corpi estranei e pazienti con problemi renali “, ha detto.
La dott.ssa Helmer ritiene che l’MBI si inserisca nella nicchia che integra mammografia ed ecografia e, come la risonanza magnetica al seno, fornisce dati sull’attività metabolica di un’anomalia nel seno o su un’area di interesse che può destare preoccupazione.
“Rispetto alla mammografia, l’MBI consente una migliore rilevazione di lesioni molto piccole nelle donne con tessuto mammario denso. Questo non solo aiuterà a eliminare i falsi positivi, ma potrebbe aiutare a rilevare i tumori al seno prima quando la malattia è datata “, ha detto. “Non è un sostituto della mammografia, ma offre a noi un’altra possibilità di guardare un paziente con un seno denso o altri problemi al seno. È un altro strumento nel nostro armamentario e ci dà dati, proprio come la risonanza magnetica. ”
MBI è anche utile per seguire la risposta alla chemioterapia noeadiuvante. “A volte, quando segui i pazienti con mammografia o ecografia per vedere la risposta alla loro chemioterapia, il tumore potrebbe non sembrare di dimensioni diverse perché non siamo in grado di valutare realmente come risponde alla chemioterapia. Considerando che con risonanza magnetica e MBI, possiamo vedere che è meno vascolare e che sta rispondendo alla chemioterapia. MBI è un modo più economico per fare questo follow-up “, ha detto.
Per il Dr. Helmer e gli altri radiologi del Cancer Center di Karmanos, l’MBI è un altro strumento nel loro arsenale di imaging che consente loro di offrire più servizi diagnostici e terapeutici e di offrire ai pazienti più scelte per una cura migliore.
Conclusione
Oggi, la mammografia rimane la prima linea di difesa per rilevare il cancro al seno nelle sue prime fasi.
“È importante sottolineare che una mammografia annuale è ancora raccomandata e che né l’ecografia né la risonanza magnetica sono destinate a sostituire la mammografia”, hanno osservato Ellen Mendelson, MD, co-investigatore e Lee F. Rogers, professore di radiologia presso la Feinberg School of Medicine, Northwestern Università, Chicago, IL.
Ciononostante, esistono limitazioni alla mammografia 2D e gli ultrasuoni supplementari e lo screening MRI aiutano a rilevare più tumori, così come la tomosintesi, la Cesm e l’MBI, se combinati con i dati mammografici.
Con la tendenza crescente nella difesa dei pazienti che estende la conversazione sullo screening mammario in pubblico dominio, i radiologi stanno rispondendo espandendo il loro portafoglio di servizi di imaging. In quanto tale, vi è un ruolo importante che le tecnologie aggiuntive svolgeranno nel futuro dello screening mammario.
Riferimenti
- Boyd NF, Guo H, Martin LJ, et al. Densità mammografica e rischio e rilevazione del cancro al seno. N Engl J di Med. 2007; 356: 227-236M.
- Yaghjyan L, Colditz GA, Collins LC, et al. Densità mammografica mammografica e conseguente rischio di carcinoma mammario nelle donne in postmenopausa in base alle caratteristiche del tumore. J Natl Cancer Inst. 2011; 103: 1179-1189. doi: 10,1093 / jnci / djr225. Epub 2011 27 luglio.
- Sei denso? http://www.areyoudense.org/. Consultato il 4 febbraio 2013.
- Stomper PC, D’Souza, DJ, DiNitto PA, Arredondo MA. Analisi della densità parenchimale su mammografie in 1353 donne di 25-79 anni. AJR Am J Roentgenol. 1996; 167: 1261-1265.
- Berg WA, Zhang Z, Lehrer D, et al. Rilevazione del carcinoma mammario con aggiunta di ecografia di screening annuale o di una singola RM di screening alla mammografia in donne con rischio elevato di cancro al seno. JAMA . 2012; 307: 1394-1404. doi: 10.1001 / jama.2012.388.
- Skaane P, Gullien R, Eben EB, et al. Tempo di lettura di FFDM e tomosintesi in un programma di screening basato sulla popolazione. Riunione annuale della Radiological Society of North America. Chicago, IL, 2011.
- Philpotts, L, Raghu, M, Durand, M, et al. Scuola di Medicina dell’Università di Yale. Esperienza iniziale con tomosintesi del seno digitale nella mammografia di screening. Presentato il 3 maggio 2012 all’American Roentgen Ray Society Annual Meeting.
- Hillman BJ, Harms SE, Stevens G, et al. Prestazioni diagnostiche di un sistema di imaging RM mammario 1,5 T dedicato. Radiologia. 2012; 265: 51-58.
- Rhodes DJ, Hruska CB, Phillips SW, et al. Dedicated gamma imaging a doppia testa per lo screening del carcinoma mammario in donne con mammografia mammaria densa. Radiolgia. 2011 Jan; 258 (1): 106-118. doi: 10.1148 / radiol.10100625. Epub 2010 2 novembre.
Ecografia Mammaria Automatica Volumetrica (EMAV)
Innovativo sistema di screening del tumore della mammella per le donne con tessuto mammario denso.
La mammografia potrebbe non rilevare oltre un terzo dei tumori laddove il tessuto mammario è particolarmente denso.1 Il sistema ABUS (Automated Breast Ultrasound System) rappresenta quindi una pratica alternativa non ionizzante alle altre opzioni di screening per le donne con tessuto mammario denso. Affiancato alla mammografia, il sistema ABUS è in grado di migliorare la rilevazione dei tumori invasivi della mammella del 55% rispetto all’utilizzo della sola mammografia.2
Circa il 40% delle donne ha un tessuto mammario denso.3 Tale condizione aumenta la percentuale di rischio di sviluppare un tumore di 4-6 volte.4 La mammografia potrebbe non individuare la presenza di un tumore nelle mammelle a tessuto denso. Il sistema ABUS si è dimostrato in grado di aiutare i medici a rilevare il 55% in più dei tumori invasivi in presenza di risultati mammografici normali o benigni.
Il processo di acquisizione del sistema ABUS utilizza la tecnologia a ultrasuoni 3D per acquisire le immagini del tessuto mammario denso in modo confortevole e rapido. Ogni esame richiede all’incirca 15 minuti.Il volume 3D e l’accesso multiplanare consentono di analizzare il tumore della mammella in modo accurato e non invasivo prima di procedere chirurgicamente grazie alla vista globale della mammella5.
Il sistema utilizza un trasduttore ad alta frequenza da 14 MHz che viene posizionato sulla mammella ed effettua una scansione automatica di un’area di circa 15 cm x 17 cm per produrre immagini volumetriche ad alta risoluzione del seno. Il meccanismo di bloccaggio del braccio che supporta il trasduttore e i pre-set ottimizzati consentono di ottenere un’immagine diagnostica accurata, oltre a ridurre notevolmente la dipendenza dell’esame dall’operatore. Una singola scansione dura meno di un minuto; l’intero esame, costituito da più scansioni per mammella, dura meno di 10 minuti.
VANTAGGI
Risultati riproducibili e affidabili indipendentemente dall’operatore.
Studio più accurato della lesione. A differenza dell’esame ecografico convenzionale, produce la vista coronale della mammella, ossia una visione completa e bilaterale di tutta la mammella, che fornisce un’informazione riproducibile, più simile a ciò che vede il chirurgo senologo durante l’intervento.
– eseguita dal TSRM – minimo 3 scansioni per lato \ 6 in totale – 30”-75’’ / scansione
– 10’-15’ tempo totale di esame
– relativamente facile/riproducibile
– maggiore completezza e sistematicità del campo esaminato
Uno studio multicentrico ha concluso che con la lettura di mammografia (MD) / mammografia + ecografia automatica (EMAV)
- aumento di sensibilità: 29 %
- specificità invariata
Uno studio osservazionale multicentrico su 15318 donne di screening, ad alta densità mammografica (> 50%) con lettura sequenziale DM e DM+EMAV e follow-up di 1 anno ha dimostrato che nel gruppo a cui è stata associata l’ecografia automatica sono stati diagnosticati 30 carcinomi in più su un totale complessivo di 112 carcinomi diagnosticati con un aumento di sensibilità: 27 % ma specificità critica.
Le domande che dobbiamo porci sono: l’EMAV ha un posto nello screening? Si, per validità scientifica ed inoltre:
– sensibilità eccellente
– problema di specificità (?)
– sviluppo di competenza
– curve di apprendimento
FFDM e 3D ABUS rilevano più cancri rispetto alla sola mammografia
L’aggiunta di ecografia mammaria automatizzata 3D (ABUS) alla mammografia di routine di donne a seno denso ha identificato ulteriori cancri che la sola mammografia non ha rilevato, secondo un articolo pubblicato sull’European Journal of Radiology . Nello studio sono stati rilevati 2,4 ulteriori tumori per 1.000 donne in un centro di screening del tumore della mammella ad alto volume a Stoccolma, in Svezia.
3D ABUS ottimizza le prestazioni di un esame ecografico portatile in combinazione con una mammografia. Il sistema utilizza un protocollo di acquisizione standardizzato e automatizzato, che acquisisce grandi volumi 3D che si sovrappongono e possono essere valutati in piani coronali, trasversali e sagittali. È riproducibile e non dipende dall’operatore. Le capacità della tecnologia 3D ABUS consentono il confronto temporale e possono rappresentare cancri nel piano coronale.
Il Dipartimento di Breast Imaging di Capio S: t Göran Hospital ha arruolato 1.668 donne tra novembre 2010 e febbraio 2012. Tutti avevano la densità mammaria categorizzata come ACR3 o ACR4, erano asintomatici e avevano più di 40 anni. Dopo aver avuto un campo a due viste mammografia digitale (FFDM), ogni donna ha avuto un esame 3D ABUS. Almeno tre viste di ciascun seno (laterale, antero-posteriore e mediale) sono state eseguite con il paziente in posizione supina con tessuto fibroglandolare schiacciato per compressione. Un tecnico radiologo / radiologo ha tenuto il trasduttore durante l’esame di 15 minuti.
L’autore principale e radiologo Brigitte Wilczek, MD, PhD, ha riferito che un radiologo del seno dedicato ha inizialmente interpretato il mammogramma, seguito da una revisione delle viste tridimensionali e trasversali 3D del 3D ABUS. I tempi di interpretazione erano in media di 1-2 minuti per la mammografia e 5-7 minuti per l’ABUS. Un secondo radiologo cieco ai primi risultati ha anche interpretato la mammografia. Quando le interpretazioni erano diverse, il secondo lettore ha anche esaminato l’esame 3D ABUS. Un totale di 169 (10,1%) ha richiesto una discussione da parte dei radiologi per raggiungere il consenso (78 FFDM e 91 3D ABUS).
Trentotto donne sono state richiamate per ulteriori esami, 15 a seguito di risultati sospetti sulle sole immagini di mammografia e 23 su immagini 3D di ABUS da sole. Undici donne con mammografia sospetta sono state sottoposte a biopsia e a sette è stato diagnosticato un cancro. Il cancro è stato rilevato in quattro delle 12 donne sottoposte a biopsie basate su risultati osservati solo su 3D ABUS. Due di queste quattro donne avevano anche metastasi ascellari. Sebbene 3D ABUS abbia rilevato quattro casi di cancro che non potevano essere visti sulla mammografia, due carcinomi duttali in situ (DCIS) erano visibili solo su immagini mammografiche.
Gli autori hanno sottolineato che se 3D ABUS non fosse stato eseguito, 23 donne sarebbero state richiamate invece di 15 sulla base di risultati sospetti sulla mammografia. L’aggiunta di 3D ABUS ha eliminato la necessità di richiamare otto pazienti. Ma i tassi di richiamo in generale con l’uso combinato di mammografia e 3D ABUS sono quasi raddoppiati, da 13,8 richiami a 1.000 donne che hanno solo mammografie, a 22,8 con donne che hanno entrambi gli esami.
Gli autori hanno sottolineato che l’obiettivo del loro studio era quello di determinare se fosse sia diagnosticamente valido e fattibile implementare un protocollo di screening del tumore al seno doppio esame per le donne con seni densi in un centro di imaging ad alto volume occupato. Lo studio ha confermato entrambi.
Gli autori hanno espresso preoccupazione per il tempo supplementare richiesto sia per eseguire e interpretare gli esami 3D ABUS. Sebbene non abbiano avuto accesso durante lo studio a un sistema di rilevamento assistito da computer per 3D ABUS, raccomandano il suo utilizzo come un modo per ridurre il tempo di lettura.
RIFERIMENTO
- Wilczek B, Wilczek HE, Rasouliyan L, et al. Aggiunta di 3D Automated Breast Ultrasound allo screening mammografico in donne con seni eterogenei ed estremamente densi. Rapporto da un programma di screening del carcinoma mammario monocentrico ad alto volume basato su ospedale. Eur J di Radiol . 2016 85; 9: 1554-1563.
September 18, 2012 — The US Food and Drug Administration (FDA) today approved the first ultrasound device for use in combination with mammography in women with dense breast tissue.
The device, known as the somo-v Automated Breast Ultrasound System(ABUS; U-Systems Inc, Sunnyvale, California), provides clinicians with an additional resource in screening women with dense breasts. The indication is limited to use in women who have a negative mammogram and no symptoms of breast cancer.
Mammograms of dense breasts can be difficult to interpret, the FDA points out in its announcement of the approval.
“A physician may recommend additional screening using ultrasound, for women with dense breast tissue and a negative mammogram,” said Alberto Gutierrez, PhD, director of the Office of In Vitro Diagnostic Device Evaluation and Safety at the FDA’s Center for Devices and Radiological Health. “The somo-v ABUS is a safe and effective breast ultrasound tool when such screening is recommended.
About 40% of women undergoing screening mammography have dense breasts, according to National Cancer Institute estimates. These women have an increased risk for breast cancer, with detection usually at a more advanced and difficult-to-treat stage, the FDA said.
In April, an expert advisory committee of the FDA voted unanimously to recommend the expanded use of ABUS as a screening tool for women with dense breast tissue.
However, as reported by Medscape Medical News, some of the panel members had concerns about ABUS because of its automated nature. In contrast to handheld ultrasound, medical specialists who operate an automated ultrasound do not have to be imaging experts, Robert Faulk, MD, from Medical Imaging Consultants in Omaha, Nebraska, noted during the meeting. “For instance, obstetricians and gynecologists could do ABUS and interpret the results themselves, along with mammography findings,” Dr. Faulk said. “That could have a deleterious effect on healthcare for many women,” he added.
“ABUS as a screening tool could potentially be applied to 40 million women in the United States [with dense breasts], and if it were used by nonimaging specialists, the false-positive rates could go through the ceiling,” said Daniel Kopans, MD, from Harvard Medical School in Boston, Massachusetts. Dr. Kopans commented that postmarket surveys of the false-positive rate from ABUS could provide important data on the effect of its use as a screening tool in women with dense breasts.
Fibroglandular breast tissue and tumors both appear as solid white areas on mammograms, which can complicate interpretation. Dense breast tissue may obscure smaller tumors, potentially delaying detection of breast cancer, according to the FDA.
Ultrasound imaging has been proven capable of detecting small masses in dense breasts.
A clinical study has shown a statistically significant increase in breast cancer detection when ABUS images were reviewed in conjunction with mammograms compared with mammograms alone. The study involved board-certified radiologists who reviewed mammograms alone or in conjunction with ABUS images for 200 women with dense breasts and negative mammograms.
As part of the approval, the FDA requires that the manufacturer train physicians and technologists using the ABUS device, and that the manufacturer provide each facility with a manual clearly defining system tests required for initial, periodic, and yearly quality control measures.
ABUS aumenta la fiducia dei radiologi nella visualizzazione di masse benigne
La scansione automatizzata del volume al seno aumenta la fiducia dei radiologi nella visualizzazione di masse benigne, secondo uno studio pubblicato nel numero di luglio di Academic Radiology . Lo studio è stato condotto per valutare in che modo i radiologi visualizzano le caratteristiche rilevanti delle lesioni osservate con ultrasuoni mammari automatici (ABUS) rispetto agli ultrasuoni portatili, secondo il suo autore principale, il radiologo Cherie M. Kuzmiak, DO, direttore della divisione imaging mammaria di l’Università della Carolina del Nord a Chapel Hill.
Venticinque donne consecutive che erano state programmate per sottoporsi a una biopsia al seno per almeno una lesione sono state reclutate per lo studio. Uno dei pazienti aveva seni estremamente densi, 11 pazienti avevano seni eterogenei densi e 13 avevano aree sparse di densità fibroglandolare. Sono state identificate un totale di 30 masse. Sette messe erano maligne.
Tutti gli esami a ultrasuoni portatili sono stati eseguiti da un singolo radiologo che ha eseguito ecografia mammaria per più di 20 anni. Lo scanner ABUS (sistema Acuson S2000 ABVS, Siemens Medical Solutions) è stato utilizzato per acquisire 320 set di dati bidimensionali trasversali ad alta risoluzione con un’ampia apertura. I dati del volume sono stati acquisiti con uno spessore della sezione di 0,5 mm. Per tutte le scansioni, la direzione di scansione è stata da superiore a inferiore con un tempo di scansione di circa 60 secondi.
Cinque esperti radiologi di imaging mammario hanno esaminato i casi. Nessuno ha avuto una precedente esperienza clinica nell’interpretazione delle immagini acquisite da ABUS. Non sono state identificate differenze significative di sensibilità o specificità tra i due tipi di immagini acquisite tramite ultrasuoni.
Tuttavia, “i radiologi hanno mostrato un aumento statisticamente significativo della fiducia nella visualizzazione del lettore nella forma e nel margine delle lesioni benigne e una pari sicurezza nella visualizzazione di lesioni sospette con ABUS rispetto all’ecografia mammaria palmare”, hanno scritto gli autori. Hanno attribuito l’aumento della fiducia dei lettori alla generazione aggiuntiva di un piano di osservazione coronale.
“Una delle maggiori preoccupazioni di ABUS è il numero di richiami per l’imaging aggiuntivo e / o la richiesta di ultrasuoni palmari supplementari necessari con questa tecnologia. Con i risultati del nostro studio, questa ulteriore ecografia manuale può essere eliminata o ridotta. Ciò dovrebbe aumentare il rendimento del paziente perché la maggior parte dei risultati del seno a ultrasuoni del seno intero sono benigni “, hanno concluso.
I risultati di questo studio sono stati presentati per la prima volta in una sessione scientifica a RSNA 2013.
RIFERIMENTO
- Kuzmiak CM, Ko EY, Tuttle LA, et al. Ultrasuoni al seno intero: confronto della visibilità delle lesioni sospette con scansione volumetrica al seno automatizzata rispetto all’ecografia del seno a mano. 2015 Acad Radiol. 22 (7): 870-879.
- Kolb, T., Lichy, J., Newhouse, J.H., Comparison of the Performance of Screening Mammography, Physical Examination, and Breast US and Evaluation of Factors that Influence Them: An Analysis of 27,825 Patient Evaluations Radiology 2002; 225:165–175
2. Brem RF, Tabár L, et.al. Assessing Improvement in Detection of Breast Cancer with Three-dimensional Automated Breast US inWomen with Dense Breast Tissue:
The SomoInsight Study. Radiology.2015 Mar; 274(3): 663-73
3. Pisano, E.D., Gatsonis, C., et. al. Diagnostic Performance of Digital versus Film Mammography for Breast-Cancer Screening, N Engl J Med 2005;353. 1- 11
4. Boyd, N.F., Guo, H., et. al., Mammographic Density and the Risk and Detection of Breast Cancer N Engl J Med 2007, 356 (3): 227-2362
5. Grady et al: Sonographic tomography for preoperative staging og breast cancer prior to surgery. Elsevier, Journal of Ultrasound, 10.1016/j.jus 2010.07.005
- Comparison and Combination of Strain and Shear Wave Elastography of Breast Masses for Differentiation of Benign and Malignant Lesions by Quantitative Assessment: Preliminary Study.[J Ultrasound Med. 2018]
- Comparison of shear-wave and strain ultrasound elastography in the differentiation of benign and malignant breast lesions.[AJR Am J Roentgenol. 2013]
- Diagnostic performance of quantitative shear wave elastography in the evaluation of solid breast masses: determination of the most discriminatory parameter.[AJR Am J Roentgenol. 2014]
- [Ultrasound elastography].[Radiologe. 2015]
- The Role of Sonoelastography in Breast Lesions.[Semin Ultrasound CT MR. 2018]
- Future of breast elastography
Future of breast elastography
Ultrasonography. 2019 Apr; 38(2)93
- Disease phenotype and genotype are associated with shifts in intestinal-associated microbiota in inflammatory bowel diseases.[Inflamm Bowel Dis. 2011]
- Review WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 2: breast.[Ultrasound Med Biol. 2015]
- Review WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 1: basic principles and terminology.[Ultrasound Med Biol. 2015
- Review Sonographic breast elastography: a primer.[J Ultrasound Med. 2012]
- Review Shear-wave elastography in breast ultrasonography: the state of the art.[Ultrasonography. 2017]
- Strain elastography for prediction of breast cancer tumor grades.[J Ultrasound Med. 2014]
- Real-time ultrasound elasticity of the breast: initial clinical results.[Ultrasound Q. 2010]
- Sonoelastography of Breast Lymphoma.[Ultrasound Q. 2016]
- Sonographic Elastography of Mastitis.[J Ultrasound Med. 2016]
- Diagnostic Performance and Accuracy of the 3 Interpreting Methods of Breast Strain Elastography: A Systematic Review and Meta-analysis.[J Ultrasound Med. 2019]
- Review Exploring the Negative Likelihood Ratio and How It Can Be Used to Minimize False-Positives in Breast Imaging.[AJR Am J Roentgenol. 2018]
- Review WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 2: breast.[Ultrasound Med Biol. 2015]
- Shear-wave elastography improves the specificity of breast US: the BE1 multinational study of 939 masses.[Radiology. 2012]
- Shear-wave elastography of the breast: value of a quality measure and comparison with strain elastography.[Radiology. 2015]
- Review WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 2: breast.[Ultrasound Med Biol. 2015]
- Sonographic Elastography of Mastitis.[J Ultrasound Med. 2016]
- Application of 3D and 2D quantitative shear wave elastography (SWE) to differentiate between benign and malignant breast masses.[Sci Rep. 2017]
- Automated 3D ultrasound elastography of the breast: a phantom validation study.[Phys Med Biol. 2016]
- US Time-Harmonic Elastography: Detection of Liver Fibrosis in Adolescents with Extreme Obesity with Nonalcoholic Fatty Liver Disease.[Radiology. 2018]
Ultrasuonografia mammaria automatizzata: un aggiornamento
Con l’aumento della consapevolezza del paziente e del paziente sulla densità del seno e la sua relazione con il cancro al seno, insieme al passaggio delle leggi sulla notifica della densità del seno da parte di molti stati, i radiologi stanno prendendo in considerazione l’ecografia supplementare per lo screening del cancro al seno. L’ecografia automatizzata del seno (ABUS) ha ricevuto l’approvazione della FDA 1 come aggiunta alla mammografia di screening in pazienti con seno denso nel 2012 e si prevede che superi i limiti dell’uso off-label dell’ecografia portatile per lo screening mammario. Con l’approvazione della FDA di ABUS arriva un requisito di otto ore di formazione peer-to-peer. Questo articolo rivede lo stato attuale di ABUS e considera la necessità e il formato della formazione.
Densità del seno e rischio di cancro al seno
La maggior parte dei radiologi riferisce la densità del seno utilizzando l’American College of Radiology Breast Imaging Reporting e Data System 2 (BI-RADS ® ), che va da quasi interamente grasso (meno del 25% ghiandolare) attraverso densità fibroglandolari sparse (circa 25-50% ghiandolare) , densamente eterogeneo (circa 51-75% ghiandolare) ed estremamente denso (più del 75% ghiandolare), basato su una determinazione visiva. L’aumento della densità mammaria è generalmente definito come seno con valutazioni di densità BI-RADS di 3 e 4 (tessuto mammario eterogeneo denso ed estremamente denso). Dai primi rapporti sull’associazione dell’aumentata densità mammaria di Wofle 3,4 e Tabar, 5Gli studi pubblicati sulla densità del seno e il suo rapporto con il rischio di cancro al seno sono ora numerosi e in crescita.
La densità mammografica mammografica è un fattore di rischio indipendente per il cancro al seno. Il grado di rischio che è più spesso citato è 4-6X. 6 L’ applicazione di questo rischio a tutti i pazienti con seno denso è errata e fuorviante; è importante inserirlo nel contesto corretto. L’aumento del rischio “4-6X” è il risultato del confronto del rischio di cancro al seno in pazienti con seni estremamente densi a pazienti con seni quasi interamente grassi (<10% densi), ciascuno dei quali rappresenta circa il 10% della popolazione statunitense. 7 Il rischio relativo è 1,5 o meno per il resto dei pazienti con seno eterogeneo denso, rispetto a quelli con densità fibroglandolare sparsa, che rappresentano ciascuno il 40% circa della popolazione. 7
Aumentare la consapevolezza della densità del seno del paziente
Un sondaggio Harris del 2009 ha mostrato scarsa consapevolezza dei pazienti sulla densità del seno personale e sulla sua relazione con il rischio di cancro al seno. 8 A quel tempo, il 90% dei pazienti non era a conoscenza della propria densità mammaria e il 95% non era a conoscenza di un aumento del rischio di cancro al seno. La prima normativa che impone la copertura dei pagatori per lo screening supplementare del tumore al seno per i pazienti con seno denso e la notifica di densità mandata successivamente dal Connecticut nel 2009, ha portato l’attenzione nazionale su questo problema. 9 Al momento della stesura di questo documento, 15 stati hanno approvato simili leggi sulla “densità informativa” e una legge federale è stata introdotta (HR 3404). 10 Inoltre, la FDA sta valutando di richiedere la notifica della densità del seno ai pazienti attraverso un cambiamento normativo. 11
Software automatizzato di densità del seno: è necessario?
Alcuni hanno opinato che il software di densità automatizzata sia necessario per affrontare i problemi di riproducibilità della classificazione di densità tra i radiologi, 12 mentre altri hanno messo in dubbio l’uso di dati mammografici 2D per valutare la densità di un organo tridimensionale. 13 radiologi della comunità che assegnavano la classificazione della densità di BI-RADS ® in uno studio prospettico di oltre 60.000 pazienti erano in grado di mostrare un rischio aumentato di 4,6 volte di cancro al seno per seni estremamente densi rispetto ai seni grassi. 14Certamente, la valutazione della densità del seno con sistemi automatici è probabilmente più riproducibile rispetto ai radiologi che usano BI-RADS, ma non è necessario iniziare un programma di screening ecografico. Ciò che spesso si perde nella discussione sulla necessità di una misurazione della densità più robusta è che la maggior parte, se non tutti, degli studi di ecografia pubblicati (vedi sotto), utilizza la valutazione della densità di BI-RADS per identificare quei pazienti da sottoporre a screening con ultrasuoni . L’effetto di mascheramento della densità stessa è importante almeno quanto il rischio di cancro al seno nella selezione dei pazienti da sottoporre a screening.
Ultrasuoni al seno per lo screening
La mammografia di screening è l’unico metodo di rilevamento mostrato per ridurre la mortalità dal cancro al seno in studi randomizzati controllati. In una revisione della lunga prova di due paesi in Svezia, i dati iniziali che mostrano una riduzione della mortalità del 30% tra i pazienti “invitati” allo screening sono rimasti stabili. 15 Tuttavia, il beneficio di mammografia è limitata in pazienti con seni densi secondarie all’effetto mascheramento della densità stessa. 16-18
Prima del 2010, nove studi pubblicati che utilizzavano ultrasuoni per integrare la mammografia per lo screening in quasi 60.000 pazienti hanno mostrato un tasso di rilevamento aumentato di circa 3,5 cancri per mille. 16,17, 19-25 Gli studi pubblicati da allora hanno mostrato tassi di rilevamento simili. Per molte mammografie e medici referenti, sembra chiaro che in questa popolazione sia necessaria una qualche forma di screening supplementare e, a causa delle limitazioni inerenti allo screening con ultrasuoni palmari (HHUS), molti radiologi stanno prendendo in considerazione l’ecografia automatizzata del seno. La speranza è che ABUS sia in grado di ridurre il tempo di acquisizione delle immagini (in media 19 minuti per le scansioni HHUS eseguite dal medico 17 ), nonché di ridurre la dipendenza dell’operatore, un problema di lunga data associato ai dispositivi HHUS.
Due tecnologie sono disponibili per ABUS. Uno utilizza un trasduttore palmare di dimensioni standard guidato da un braccio articolato automatizzato, che genera immagini 2D standard interpretate in un formato cine. Questo esame richiede che le immagini vengano acquisite da un ecografista, sebbene abbia il potenziale per limitare la dipendenza dell’operatore. L’unica ricerca pubblicata mostrava una buona sensibilità e specificità. 16La seconda tecnologia in competizione utilizza un trasduttore di grande formato; in genere, vengono acquisiti sei volumi 3D nel piano trasversale, tre per ciascun seno. Questo dispositivo può essere utilizzato praticamente da chiunque dopo un periodo di formazione pratica di tre giorni, con la possibilità di ridurre il tempo di ecografia e la dipendenza dell’operatore. I set di dati volumetrici vengono inviati immediatamente a una stazione di lavoro dedicata, dove le immagini trasversali vengono ricostruite in piani coronali e sagittali con spessore della fetta regolabile dall’utente che va da 0,5 mm a 3 mm in tutti e tre i piani ortogonali, nonché affettamento radiale e anti-radiale . La revisione dell’esame è, pertanto, simile a MRI o CT, con set di dati 3D multiplanari e immagini contigue (Figura 1).
Tasso di richiamata
Una critica allo screening degli ultrasuoni al seno è il potenziale aumento dei tassi di callback e delle interpretazioni falso-positive. Certamente, la recente esperienza pubblicata giustifica le critiche. Qual è un tasso di risposta accettabile quando si integra la mammografia con gli Stati Uniti? Molti direbbero “zero”, ma questo non è realistico, in quanto nessuna tecnologia di imaging ha mai raggiunto la perfetta sensibilità e specificità. Un ragionevole compromesso sarebbe un aumento del tasso di richiamata equivalente all’aumento del tasso di rilevamento del cancro. Ad esempio, si consideri un tasso di rilevamento del cancro mammografico di 5/1000 e un tasso di richiamata del 10%: se il rilevamento del cancro dell’ultrasuono supplementare è un ulteriore 3/1000, potremmo accettare un tasso di richiamo ultrasonico di screening del 6% (aumento del 60% nel tasso complessivo di rilevamento del cancro).
È possibile implementare due flussi di lavoro per ABUS. Il primo è interpretare la mammografia di screening, e se è negativa e densa, allora offri ABUS. Sebbene sia coerente con l’indicazione per l’uso approvata dalla FDA, questa opzione potrebbe richiedere un secondo appuntamento per il paziente se la mammografia non viene interpretata immediatamente. Ricordare efficacemente tutti i pazienti con tessuto mammario denso e mammografia normale riduce l’accettazione di ABUS.
Il secondo flusso di lavoro è quello di offrire ABUS immediatamente dopo la mammografia, sulla base della sola valutazione della densità. Nell’esperienza di questo autore, questo approccio off-label aumenta notevolmente l’accettazione da parte del paziente. Un tecnologo radiologo esperto può eseguire la valutazione della densità, che era l’approccio utilizzato dal prospetto Somo * Insight Registry Study o, in alternativa, un software di densità computerizzato come Quantra, Vu-Comp o Volpara, può essere usato per triageare i pazienti in ABUS e gruppi no-ABUS. Simile a un mammografo, il software di densità computerizzato può immediatamente riportare la percentuale di densità mammaria, ma questi risultati sono oggettivi anziché affidarsi alla soggettività di un tecnologo. Se i risultati della valutazione della densità producono una percentuale di tessuto fibroglandolare> 50% del volume del seno, L’ABUS può essere eseguita dopo la mammografia e prima dell’interpretazione mammografica. Questo approccio ha il potenziale per compensare i richiami mammografici dovuti alle cisti, dato che le cisti benigne diagnosticate su ABUS non avrebbero bisogno di un’ecografia palmare per la diagnosi.
Come Laszlo Tabar insegna spesso in mammografia, “lo screening non è una diagnosi”, e questo vale anche per gli ultrasuoni del seno. Lo screening degli ultrasuoni al seno richiede un cambio di paradigma nell’approccio all’interpretazione del radiologo. La maggior parte dei radiologi, che non hanno eseguito ecografia mammaria di screening, di solito si avvicinano allo screening statunitense dal punto di vista diagnostico. Il tasso di rilevamento del cancro di uno studio di screening è circa dieci volte più basso rispetto a uno studio diagnostico. 26 Ciò considerato, la probabilità di malignità dei reperti rilevati con lo screening del seno negli Stati Uniti che verrebbe chiamata probabilmente benigna (BI-RADS ® 3) sugli Stati Uniti diagnostici è molto più basso e potrebbe non giustificare il richiamo. È stata avanzata una richiesta per sviluppare nuovi criteri per classificare le masse solide e cistiche benigne che appaiono agli ultrasuoni di screening. 27
Approvazione da parte della FDA (PMA) / studio del lettore
L’approvazione della FDA negli Stati Uniti è richiesta da un produttore di dispositivi prima di commercializzare prodotti come la tomosintesi digitale e ABUS per nuove indicazioni relative al rilevamento o alla diagnosi di malattie come il cancro al seno. Per dimostrare la sicurezza e l’efficacia, gli studi del lettore sono la metodologia preferita, dato il tempo e il costo più brevi rispetto a uno studio pluriennale di migliaia di pazienti necessari in una popolazione di screening con una bassa incidenza e / o prevalenza di malattia (ad esempio, cancro al seno) . La FDA ha concesso l’approvazione prematrimoniale (PMA) 1 il 18 settembre 2012 ad ABUS come coadiuvante della mammografia per lo screening in pazienti con seni eterogenei ed estremamente densi dopo aver esaminato i risultati dello studio Pivotal Clinical Retrospective Reader (USI 2011001, PIVotal CRRS) . 28
Nel primo giorno di studio del lettore, i 17 radiologi partecipanti hanno ricevuto 80 ore di formazione nell’interpretazione di ABUS, data la natura unica dell’acquisizione 3D e della visualizzazione delle immagini del seno. Nei giorni 2 e 3, i lettori hanno interpretato 200 casi, la maggior parte compresi i mammogrammi digitali seguiti da ABUS. Nella tipica progettazione dello studio del lettore, i lettori sono stati prima istruiti a fornire una valutazione iniziale della categoria BI-RADS, seguita da un BI-RADS forzato (se diverso dalla categoria di valutazione 1 o 2), probabilità di malignità dall’1 al 100% (LOM) per un massimo di tre lesioni in ciascun seno e, infine, valutazione BI-RADS e LOM per l’intera mammografia. Dopo aver registrato i risultati, i lettori hanno interpretato l’esame ABUS in modo simile. L’obiettivo dello studio era determinare se le prestazioni del lettore per il rilevamento del carcinoma mammario fossero migliorate quando la mammografia digitale combinata con ABUS, rispetto all’utilizzo della sola mammografia digitale, nei pazienti con valutazione della densità BI-RADS 3/4 e assegnata una categoria di valutazione BI-RADS 1 / 2 (negativo / benigno). Le prestazioni del lettore sono state valutate valutando l’area sotto la curva caratteristica operativa (ROC) di Reader (AUC).
Lo studio del lettore ha dimostrato un miglioramento statisticamente significativo della sensibilità di rilevazione del cancro al seno quando la mammografia digitale è stata integrata con ABUS. È importante sottolineare che non vi è stata una diminuzione statisticamente significativa della specificità. Dati gli studi precedenti che mostravano una diminuzione della specificità dello screening dell’ecografia mammaria, la FDA ha imposto che i radiologi che acquistano ABUS ricevessero una formazione sostanzialmente simile ai lettori nello studio Pivotal Clinical Retrospective Reader. 17 Il Pivotal CRRS è stato presentato per la pubblicazione.
Poiché i casi non tumorali con precedente intervento mammario non sono stati inclusi nel PIVOTal CRRS, l’approvazione della FDA limita lo screening di ABUS a pazienti asintomatici senza intervento preventivo sul seno oltre alla mammografia normale e> 50% di densità mammaria. Per questo motivo i risultati Pivotal CRRS pubblicamente commercializzati rappresentano una sottoanalisi del set di dati PIVotal CRRS, che include solo il sottoinsieme di casi che soddisfano i criteri della popolazione di pazienti descritti dall’indicazione di utilizzo approvata.
Specifiche di formazione ABUS
La formazione dei lettori combina l’orientamento con la workstation unica che visualizza i set di dati 3D, compresa la “manopolaologia” e la direzione sulla valutazione dei set di dati 3D in una progressione logica graduale, con un approccio allo screening del cancro al seno usando ABUS, con l’obiettivo di migliorare la sensibilità senza influire negativamente specificità (tassi di callback). Dimostrare l’acquisizione dal vivo o registrata dei set di dati del volume 3D ABUS aiuta il radiologo ad apprezzare la natura unica del trasduttore di grande formato (Figura 2) e mette in contrasto le dimensioni del trasduttore portatile e del trasduttore ABUS (Figura 3). La comprensione delle informazioni ridondanti fornite in serie di dati 3D sovrapposte migliora la sensibilità e la specificità (Figure 4 e 5).
La formazione è divisa in quattro moduli. Il modulo 1 è un webinar di un’ora e peer-to-peer con un orientamento iniziale a ABUS. Il modulo 2 è una sessione basata su web di tre esercitazioni di casi di ABUS autogestiti. I moduli 3 e 4, che rappresentano i “dadi e bulloni” dell’interpretazione di ABUS, consistono in istruzioni interattive peer-to-peer dal vivo con interpretazione ABUS pratica e valutazione della qualità dell’immagine. I moduli 3 e 4 possono essere consegnati di persona da un Peer Educator qualificato (Figura 8), o da remoto attraverso un’aula virtuale che utilizza la condivisione bilaterale del desktop remoto tra Peer Educator e ABUS Learner con video / videoconferenza dal vivo. Una volta completato l’allenamento, ogni studente ABUS completa un’autovalutazione finale di 10 casi al proprio ritmo per valutare le prestazioni individuali. Il carico di lavoro consiste in studi cancerogeni, benigni e normali.
Conclusione
La consapevolezza crescente del medico e dei pazienti di un aumento del rischio di cancro al seno a causa della densità del seno e dei limiti associati della mammografia ha guidato la legislazione sulla notifica della densità del seno, nonché la ricerca e lo sviluppo di strumenti di screening aggiuntivi come l’ecografia automatizzata del seno .. Dati i limiti del tempo di scansione e la dipendenza dell’operatore dall’ecografia portatile per lo screening, ABUS sembra essere un’alternativa utile. I risultati dello studio del lettore sono promettenti e l’allenamento del radiologo è importante per massimizzare la sensibilità pur mantenendo un’adeguata specificità. La ricerca pubblicata con ABUS è attualmente limitata. I risultati dello studio Somo * Insight Registry sono in sospeso. Ulteriori ricerche con ABUS saranno importanti per lo sviluppo di nuovi criteri per i quali le lesioni costituiscono reperti benigni e probabilmente benigni,
Riferimenti
- “Premarket Approval (PMA).” Http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=7828. Consultato il 10 dicembre 2013.
- American College of Radiology. Sistema di segnalazione e dati per l’imaging del seno. 4 ° ed. Reston, VA: American College of Radiology; 2003.
- Wolfe JN. Rischio per lo sviluppo del cancro al seno determinato dal pattern parenchimale mammografico. Cancer .1976; 37: 2486-2492.
- Wolfe JN. Modelli del seno come indice di rischio per lo sviluppo del cancro al seno. AJR Am J Roentgenol.1976; 126: 1130-1137.
- Tabar L., Dean, PB. Modelli parenchimali mammografici: indicatore di rischio per il cancro al seno ? JAMA . 1982; 247: 185-189.
- Boyd NF, Guo H, Martin LJ, et al. Densità mammografica e rischio e rilevazione del cancro al seno. N Engl J Med .2007; 356: 227-36.
- Falci, EA. L’uso dell’imaging mammario per lo screening delle donne ad alto rischio di cancro. Radiol Clin North Am.2010; 48: 859-878.
- The Harris Poll®April 28-30, 2010, Harris Interactive Inc. Tutti i diritti riservati.
- Dehkordy SF, Carlos RC. Legislazione del seno denso negli Stati Uniti: stato degli stati. J Am Coll Radiol . 2013; 10: 899-902.
- HR 3404–113th Congress: Breast Density and Mammography Reporting Act del 2013. (2013). In www.GovTrack.us. Estratto l’8 dicembre 2013 da http://www.govtrack.us/congress/bills/113/hr3404
- Registro federale: legge sugli standard di qualità della mammografia: modifiche normative. Consultato l’8 dicembre 2013. Disponibile all’indirizzo: https://www.federalregister.gov/regulations/0910-AH04/mammography-quality-standards-act-regulatory-amendments.
- Chang TS. Molto rumore per la densità mammografica mammografica. Notizie sulla tecnologia di imaging . 2012; 52: 30-32.
- Kopans DB. Fisica di base e dubbi sulla relazione tra densità tissutale determinata e rischio di cancro. Radiologia . 2008; 246: 348-353.
- Vacek PM, Geller BM. Uno studio prospettico del rischio di cancro al seno utilizzando misurazioni di mammografia mammografica di routine. Cancer Epidemiol Biomarkers Prev . 2004; 13: 715-722.
- Tabar L, Vitak B, Chen TH, et al. Studio svedese a due contea: impatto dello screening mammografico sulla mortalità per cancro al seno durante 3 decenni. Radiologia . 2011; 260: 658-663.
- Kelly KM, Dean J, Comulada WS, et al. Rilevazione del carcinoma mammario: utilizzo di ultrasuoni mammografici e mammografia automatizzati in mammelle radiograficamente densi. Eur Radiol . 2010; 20: 734-742.
- Berg WA, Blume JD, Cormack JB, et al: screening combinato con ultrasuoni e mammografia vs mammografia da sola nelle donne ad alto rischio di cancro al seno. JAMA . 2008; 299: 2151-2163.
- Saslow D, Boetes C, Burke W, et al. Linee guida American Cancer Society per lo screening mammario con risonanza magnetica in aggiunta alla mammografia. CA: Cancer J Clin . 2007; 57: 75-89.
- Gordon PB, Goldenberg SL. Masse mammarie maligne rilevate solo da ultrasuoni. Una recensione retrospettiva. Cancer. 1995; 76: 626-630.
- Buchberger W, DeKoekkoek-Doll P, Springer P, et al. Risultati casuali sull’ecografia del seno: significato clinico e analisi diagnostica. AJR Am J Roent genol. 1999; 173: 921-927.
- Kaplan SS. Utilità clinica degli Stati Uniti bilaterali a tutto il seno nella valutazione delle donne con tessuto mammario denso. Radiologia . 2001; 221: 641-649.
- Kolb TM, Lichy J, Newhouse JH. Confronto delle prestazioni della mammografia di screening, dell’esame obiettivo e del seno negli Stati Uniti e valutazione dei fattori che le influenzano: un’analisi di 27.825 valutazioni dei pazienti. Radiologia . 2002; 225: 165-175.
- Leconte I, Feger C, Galant C, et al. Mammografia e successiva sonografia di mammella intera non palpabile: l’importanza della densità mammaria radiologica. AJR Am J Roentgenol . 2003; 180: 1675-1679.
- Crystal P, Strano SD, Shcharynski S, Koretz MJ. Usando l’ecografia per schermare le donne con mammograficamente densi seni. AJR Am J Roentgenol . 2003; 181: 177-182.
- Corsetti V, Ferrari A, Ghirardi M, et al. Ruolo dell’ecografia nel rilevamento del carcinoma mammario occulto mammograficamente nelle donne con seno denso. Radiol med . 2006; 111; 440-448.
- Falci EA, Wolverton DE, Dee KE. Parametri prestazionali per screening e mammografia diagnostica: radiologi specializzati e generali. Radiologia . 2002; 224: 861-869.
- Hooley RJ, Greenberg KL, Stackhouse RM, et al. Screening USA in pazienti con mammografia mammograficamente densa: esperienza iniziale con Connecticut Public Act 09-41. Radiologia. 2012; 265: 59-69.
- Giger EL, et al. “Studio di lettori clinici che esaminano le prestazioni della mammografia e dell’ecografia automatica del seno nello screening del cancro al seno”. Presentato per la presentazione, RSNA 2012.