egli ultimi 30 anni, il numero di casi di cancro tra le persone di età inferiore ai 50 anni è aumentato di quasi l’80% in tutto il mondo. Il numero di diagnosi di tumore è aumentato da poco più di 1,8 milioni nel 1990 a oltre 3,2 milioni nel 2019, secondo lo studio pubblicato su una rivista specializzata in medicina oncologica, BMJ Oncology. Ogni anno muoiono oltre un milione di giovani malati di cancro.Il tumore della mammella è il tumore più frequente nella popolazione femminile ed è un problema sociale ed umano di notevoli proporzioni. Ogni anno in Italia circa 55.000 donne si ammalano di cancro della mammella. Si stima che nei paesi occidentali una donna su otto svilupperà un tumore mammario nel corso della vita, nel 30% in donne con età inferiore a 44 anni, nel 35% di donne comprese tra 44 e 65 anni ed il rimanente 35% dopo i 65 anni. La mortalità si attesta su circa 12.000 donne l’anno, con un calo annuale del 2% a partire dalla fine degli anni 90. Molti ed incoraggianti sono stati i passi avanti della ricerca scientifica e sempre più oggi, se diagnosticato precocemente il tumore della mammella è curabile con ricorso a terapie meno aggressive. La diagnosi precoce del carcinoma della mammella, si ottiene sottoponendosi periodicamente e non saltuariamente, a controllo clinico-mammografico, ed eventualmente ecografico, se il seno è denso.
Il seno in tutte le culture è un organo carico di significati. Il seno conferisce un’identità femminile, ma nella malattia tumorale può trasformarsi in un simbolo evocatore di morte. Alla perdita del seno si aggiunge la perdita di un’immagine di donna bella e sana, con profonde ferite psichiche e fisiche.
La prevenzione primaria ha come obiettivo la riduzione dell’incidenza dei tumori intervenendo sulla rimozione delle cause determinanti. La prevenzione secondaria si propone la riduzione della mortalità e l’aumento della sopravvivenza attraverso la diagnosi precoce.
I costi socioeconomici del tumore rischiano di esplodere se non si potenzia la prevenzione e non si riorganizza la spesa investendo sul bisogno di prevenzione non ancora soddisfatto.
La prevenzione dovrebbe essere una priorità nell’agenda politica sanitaria delle cose che si possono e si debbono fare per affrontare il tumore della mammella dal punto di vista preventivo.
La mammografia non previene dal tumore, permette di diagnosticarlo in anticipo, nella convinzione che così facendo le cure siano meno invasive e la mortalità sia ridotta. Occorre quindi un chiarimento linguistico e concettuale: la diagnosi precoce mediante mammografia o ecografia non è prevenzione è diagnosi precoce ed in medicina viene definita prevenzione secondaria. E’ una delle fonti di maggiore confusione per le donne che devono decidere se e come aderire a campagne di screening: tante donne pensano che sottoponendosi a questo test eviteranno di ammalarsi, mentre il test serve soltanto a diagnosticare precocemente l’eventuale malattia.
Se un esame è proposto a tutte le persone in una certa fascia di età e con particolari caratteristiche, si dice che è un esame di screening, cioè non basato sulle caratteristiche del singolo individuo o sulla sua storia familiare, ma su elementi condivisi dall’intero gruppo (per esempio, persone dello stesso genere e di una certa fascia di età). Uno degli elementi importanti perché un test possa diventare uno screening è che incida sulla mortalità per la malattia che diagnostica: non basta fare più diagnosi, bisogna che queste diagnosi anticipate permettano di salvare vite umane cambiando il naturale decorso della malattia.
La mammografia può essere usata per lo screening ed è quindi raccomandata e offerta gratuitamente in Italia a tutte le donne nella fascia di età tra i 50 e i 69 anni. Alcune Regioni, su indicazione del Ministero della Salute, la stanno estendendo alle donne tra i 45 e 49 anni con intervallo annuale e alle tra i 70 e 74 anni con intervallo biennale) Ciò non significa, però, che non vi siano donne che hanno bisogno di fare la mammografia anche in età più giovanile, per esempio se hanno familiarità per il cancro al seno oppure perché hanno una mammella con alcune caratteristiche particolari che, sulla base degli studi condotti finora, possono favorire la comparsa di un tumore. Nel loro caso non si parla però di screening, perché non rientrano nella categoria generale, ma di esami diagnostici prescritti sulla base di caratteristiche individuali.

LA PREVENZIONE DEL TUMORE, APPROCCIO MULTIMODALE
• Prevenzione primaria: mira a far sì che i tumori non insorgano. Il suo scopo, è ridurre l’incidenza del cancro tenendo sotto controllo le cause ed i fattori di rischio modificabili. Una corretta strategia di prevenzione primaria si basa, quindi, sull’identificazione dei fattori di rischio, sulla valutazione di quanto l’intera popolazione o il singolo individuo siano esposti a tali fattori e sulla riduzione della loro diffusione nella popolazione.
• Prevenzione secondaria: è la diagnosi precoce interviene su soggetti già ammalati, benché in uno stadio iniziale quando i sintomi non si sono ancora manifestati. Non necessariamente questi soggetti hanno già sviluppato il cancro: la loro lesione potrebbe essere di tipo precanceroso, in particolare i tumori in situ, non è cancro invasivo, ma potrebbe diventarlo. Si tenga conto che lo sviluppo del cancro spesso interessa un arco temporale anche di decine di anni. Mediante uno screening personalizzato, la diagnosi con tomosintesi, ecografia e CEM, la prevenzione secondaria mira ad ottenere la guarigione limitando la progressione del tumore.
• Prevenzione terziaria: questo approccio viene messo in atto dopo la manifestazione della patologia. Consiste in un accurato controllo clinico-terapeutico che ha l’obiettivo di evitare o comunque limitare la comparsa di complicazioni tardive e di eventuali recidive. Nell’ambito della prevenzione terziaria rientrano anche la gestione dei deficit e delle disabilità funzionali che insorgono in conseguenza di uno stato patologico o disfunzionale. In questi casi la prevenzione si realizza attraverso misure riabilitative e assistenziali volte al reinserimento familiare, sociale e lavorativo del malato e al miglioramento della sua qualità di vita.

FATTORI DI RISCHIO MODIFICABILI
• stili di vita:
• fumo
• sole e raggi ultravioletti
• alcol in eccesso
• tipo di alimentazione
• BMI, indice di massa corporea
• sovrappeso e obesità
• sedentarietà
• fattori ambientali:
• inquinamento atmosferico
• agenti chimici (es. benzene, diossine)
• sostanze presenti in natura (es. amianto, arsenico, berillio, cadmio, cromo, piombo)
• agenti fisici (radiazioni)
• agenti infettivi (es. virus Epatite B e C oHPV. Il cancro, comunque, non è una malattia contagiosa, né è provocata direttamente da virus o batteri.
• Stile alimentare mediterraneo:
 • Settimanalmente orientativamente sono previste 5 porzioni di pesce (meglio se azzurro e ricco di omega3), 7 porzioni di frutta e verdura, 3 porzioni di pollame da allevamenti non intensivi 4 porzioni di olive, legumi e noci, 3 porzioni di patate, 3 di uova e 3 di dolci. La carne rossa, da allevamenti non intensivi, è concessa 4 volte al mese. Stop ai cibi ultraprocessati.
• Settimanalmente orientativamente sono previste 5 porzioni di pesce (meglio se azzurro e ricco di omega3), 7 porzioni di frutta e verdura, 3 porzioni di pollame da allevamenti non intensivi 4 porzioni di olive, legumi e noci, 3 porzioni di patate, 3 di uova e 3 di dolci. La carne rossa, da allevamenti non intensivi, è concessa 4 volte al mese. Stop ai cibi ultraprocessati.
FATTORI DI RISCHIO NON MODIFICABILI
• età: il rischio aumenta progressivamente con l’avanzare degli anni
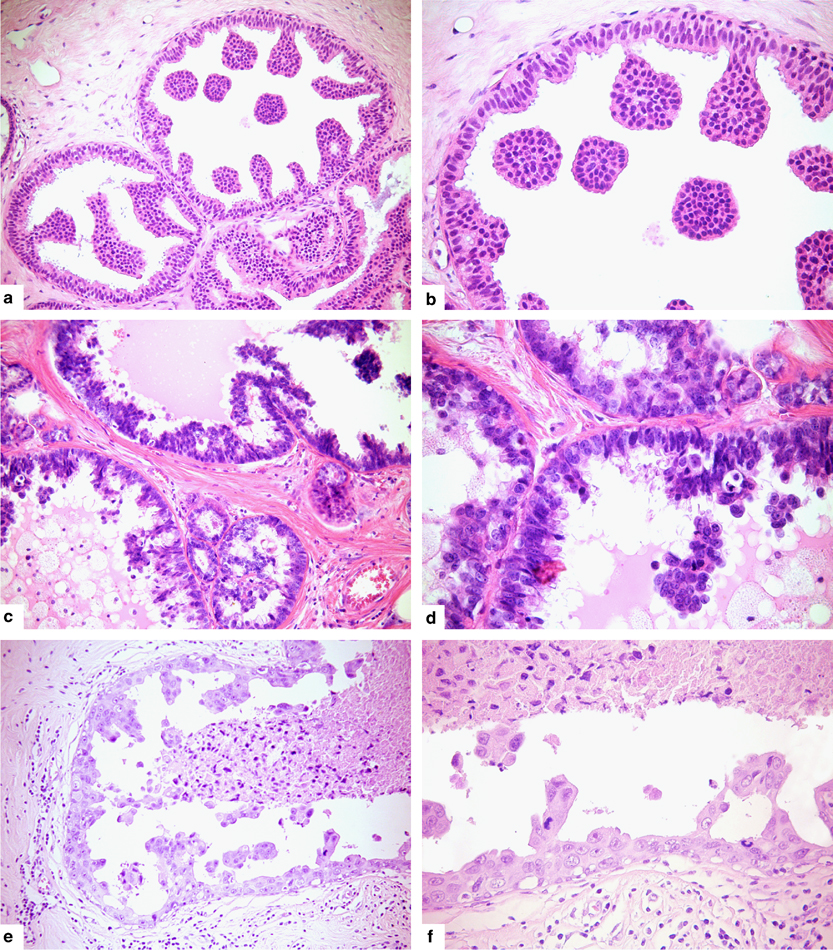
• densità mammografica: il rischio aumenta con densità c e d
• familiarità: tale fattore non identifica la certezza ma solo una maggiore predisposizione a sviluppare una determinata patologia oncologica. Quindi se in una famiglia sono stati riportati diversi casi di cancro, ciò non significa che altri membri si ammaleranno.
• È bene che tali soggetti prestino maggiore attenzione, seguano stili di vita sani, si sottopongano ai test genetici, con regolarità ai programmi di screening e ai controlli suggeriti dal proprio medico
 Da più di 20 anni la ricerca sta tentando di identificare i gruppi di donne a più alto rischio ,quelle che con più probabilità svilupperanno il tumore se non interverranno studi conclusivi poiché una donna su otto si ammalerà di tumore nel corso della vita tutte le donne occidentali, sono da considerarci ad alto rischio.
Da più di 20 anni la ricerca sta tentando di identificare i gruppi di donne a più alto rischio ,quelle che con più probabilità svilupperanno il tumore se non interverranno studi conclusivi poiché una donna su otto si ammalerà di tumore nel corso della vita tutte le donne occidentali, sono da considerarci ad alto rischio.
Il rischio è probabilità è statistica è una misura relativa è come tale ha una e rilevanza indiretta e non causale sullo sviluppo della malattia. Le donne corrono il rischio di essere ammalate di rischio con stati psico-emotivi di paure e disagio.
L’analisi genica molecolare è un test genetico che analizza regioni specifiche del DNA genomico o di Rna o di prodotti genici estratti estratti da tessuti e da linfociti allo scopo di identificare anomalie presenti nel patrimonio genetico responsabili di patologie ereditarie o di predisposizione a patologie tumorali quando la storia familiare el l’anamnesi della paziente siano a rischio per un tumore eredo-familiare.
Si calcola che che il 5-10% dei tumori della mammella e dell’ovaio siano eredo-familiari perchè correlati ad alterazioni genetiche che predispongono all’insorgenza della malattia. I soggetti portatori di alterazioni genetiche hanno una probabilità su due di trasmettere tale alterazione ai figli indipendentemente dal sesso.
Una donna portatrice di mutazione genica in uno dei due geni BRCA1 o BRCA2 ha una probabilità del 40-60% di sviluppare un carcinoma mammario nel corso della vita. Nel caso di mutazione genica del gene BRCA2 il rischio diventa alto anche per i soggetti di sesso maschile.
Il rischio di sviluppare il tumore dell’ovaio è del 30-40% se vi è una mutazione nel gene BRCA1 e del 20-25% se c’è una mutazione nel gene BRCA2.
La genetica ha fatto notevoli passi in avanti nei test diagnostici e predittivi. La donna quindi che eredita una mutazione in due geni Brca1 nel cromosoma 17 e Brca2 nel cromosoma 13 ha una possibilità cinque volte superiore di sviluppare il tumore mammario rispetto alla donna che non ha questa mutazione. Il rischio è insito nella condizione umana ,non potrà sempre essere controllato e non si può curare quello che si può solo predire. I test genetici che danno risultati probabilistici in molti casi aumentano l’angoscia riguardo alla malattia che può presentarsi dopo anni o non presentarsi affatto.
Il rapporto medico-paziente già critico rischia di essere portato all’estremo quando si tratta di comunicare diagnosi di modificazione genica con un rischio alto di una patologia tumorale che potrebbe svilupparsi. Cosa proporre ad una donna con mutazione genica: stretta sorveglianza, mastectomia profilattica o farmacoprevenzione? La donna ed il medico sono investiti da responsabilità che riguardano non solo la portatrice di mutazione ma anche il nucleo famigliare in particolare i figli .E’ giusto ricercare nelle figlie il rischio per patologie tumorali che forse si svilupperanno in età adulta?
Anche oggi l’area di ricerca che riguarda il counselling genetico è da considerarsi un’area di ricerca in larga parte sperimentale che ha vincoli di tipo etico e psicologico. E’ quindi giusto che qualsiasi iniziativa di studio sia limitata a strutture pubbliche ed a donne autoreferenti cui viene richiesto un consenso dopo una dettagliata analisi dei rischi e dei benefici, considerando lo stato psicoemotivo della donna, l’età, le possibili dinamiche famigliari e la progettualità di vita. Le donne devono sentirsi protette e seguite dalla struttura che propone il test genetico.
Spesso le mode e gli interessi economici fanno perdere di vista le linee di ricerca più promettenti sulla prevenzione e sull’impatto a livelli di sanità pubblica, non valorizzando i veri determinanti del tumore al seno .
In considerazione del nesso causale tra alimentazione e tumore qualcosa sta cambiando sulla riduzione dei rischi modificabili:stili di vita, obesità, sovrappeso, insulino-
Le donne e le loro Associazioni pretendono che gli sforzi della ricerca debbano essere canalizzati e concentrati sulla prevenzione primaria .Ribadendo come campagne di sensibilizzazione per mutare abitudini di vita errate ed iniziative che valorizzino e promuovano la qualità del cibo potrebbero avere ricadute positive ,per la salute e per la prevenzione, di portata superiore a quelle ipotizzabili con interventi medicalizzati, costosi e con conseguenze a lunga distanza non ben valutabili.
Da rimarcare infine l’importanza della comunicazione e della conoscenza per una corretta strategia di prevenzione con interventi tesi a favorire i bisogni informativi ed emotivi.
Non basta solo l’intervento sanitario e il miglioramento dei servizi, ma bisogna creare sinergie tra quanti operano nel campo dell’ambiente e dell’alimentazione.
Nel campo della prevenzione secondaria rimangono disuguaglianze nell’accesso ai servizi di diagnosi e di cura che dovranno essere superati con la rete regionale delle Breast Unit.
L’Unità di Senologia rappresenta un modello di assistenza specializzato nella diagnosi e cura del carcinoma mammario, dove la gestione del percorso della paziente è affidata ad un gruppo di esperti dedicati e con uno specifico training senologico.
L’Unità di Senologia si caratterizza per la presenza di un team coordinato e multidisciplinare, in grado di garantire quel livello di specializzazione delle cure, dalle fasi di screening sino alla gestione della riabilitazione psico-funzionale, in grado di ottimizzare la qualità delle prestazioni e della vita delle pazienti e garantendo nel contempo l’applicazione di percorsi diagnostico-terapeutici e assistenziali (PDTA) aggiornati e conformi alle linee guida nazionali e internazionali.
Le Associazioni femminili vogliono mettere a disposizione conoscenze diffondere esperienze per una società più solidale, più umana, più colta e con pari dignità per la donna che superi le disuguaglianze non più tollerabili.
L’avvento della profilazione molecolare dei tumori al seno ha portato all’identificazione di almeno 5 sottotipi molecolari intrinseci, cementando il concetto che il cancro al seno è una malattia eterogenea derivante da molteplici, ma sconosciute, eziologie. L’importanza clinica di questi sottotipi definiti molecolarmente risiede nel fatto che i tassi di sopravvivenza del cancro al seno differiscono in base al sottotipo intrinseco. I proxy clinici per i sottotipi intrinseci sono stati delineati utilizzando marcatori tumorali di routine, tra cui recettore degli estrogeni, recettore del progesterone, HER2 e grado tumorale che incorpora tassi di proliferazione, differenziazione tumorale e dismorfia nucleare. Questi sottotipi “intrinseci” clinicamente assegnati hanno permesso un ampio uso di dati di sottotipizzazione molecolare senza il necessario sequenziamento dell’RNA tumorale e sono fondamentali per la cura del paziente. Ad esempio, i pazienti con tumori luminali A in generale hanno buone prognosi e, nel complesso, questi pazienti ricevono meno chemioterapia rispetto a quelli con diagnosi di cancro al seno triplo negativo (TNBC), un sottotipo che progredisce verso metastasi più frequentemente anche dopo trattamenti combinati di chirurgia, radiazioni e chemioterapia.
Anche se la comprensione che il cancro al seno è una malattia eterogenea con esiti distinti è pienamente riconosciuta all’interno della ricerca sul trattamento e delle specialità di cura clinica, l’incorporazione di questi concetti per la prevenzione del cancro al seno sta ancora emergendo. Il potenziale per strategie di prevenzione su misura è promettente, perché mirare ai sottotipi più letali di cancro al seno avrà un grande impatto. In questo numero del Journal, Jung et al.[1] riferiscono sulle associazioni tra eventi riproduttivi, tra cui l’età del menarca, la gravidanza, la storia dell’allattamento al seno e la menopausa, e il rischio di sviluppare sottotipi specifici di cancro al seno. I risultati di questa grande meta-analisi aiutano a indicare la via da seguire ad approcci di prevenzione specifici per sottotipo- informate da una migliore comprensione dei fattori di rischio riproduttivo.
Lo studio Jung et al.[1], impressionante per dimensioni e portata, è una meta-analisi di 31 studi di caso-controllo e coorte europei-centrici, basati sulla popolazione- che sono stati messi in comune dal Breast Cancer Association Consortium. I dati sono stati armonizzati da 23 353 casi e 71 072 controlli in 16 paesi e 4 continenti, rendendolo il più grande studio del suo genere fino ad oggi. Inoltre, lo studio si basa su una tradizione storica, con una storia che copre 300 anni di ricerca. Il legame tra fattori riproduttivi e rischio di cancro al seno è stato segnalato per la prima volta nei primi anni 1700 dal dottor Bernardino Ramazzini, un medico italiano che studia la prevenzione delle malattie dal punto di vista della salute sul lavoro. Il dottor Ramazzini ha scoperto che le suore avevano tassi di cancro al seno significativamente più alti rispetto alle donne in altre professioni e ha ipotizzato che la nulliparità fosse un fattore di rischio per il cancro al seno. 2] Nel corso dei 300 anni successivi, siamo arrivati a capire che la gravidanza a termine riduce il rischio di cancro al seno (l’effetto protettivo della gravidanza); questa protezione è modificata dall’età alla prima gravidanza (il doppio effetto della gravidanza, poiché la gravidanza è protettiva se si è giovani al momento del primo parto, ma può essere promozionale se si è più anziani); e la vicinanza al parto Allo stesso tempo, l’età del menarca, l’età alla menopausa e la storia dell’allattamento al seno sono state identificate come ulteriori fattori riproduttivi che influenzano il rischio di cancro al seno.
Nonostante questa lunga, robusta e fruttuosa storia di indagine scientifica, molti solidi studi epidemiologici che indagano sui fattori riproduttivi hanno prodotto risultati contrastanti e, ad oggi, una teoria unificante su come la biologia riproduttiva influenza il rischio di cancro al seno rimane sfuggente. Una notevole limitazione di molti di questi studi epidemiologici è la messa a punto di tutti i casi di cancro al seno in una singola malattia omogenea a causa della mancanza di dati sul sottotipo intrinseco del tumore disponibili in molti studi longitudinali e del numero relativamente piccolo di casi di TNBC. Jung et al.[1] hanno superato queste barriere raccogliendo dati da molti studi che avevano dati clinici sufficienti per determinare il sottotipo del tumore. Hanno trovato una specificità intrinseca del sottotipo a molti dei fattori di rischio riproduttivo valutati.
Due osservazioni sono particolarmente degne di nota nello studio di Jung et al.,[1] perché hanno un alto potenziale traslazionale per quanto riguarda gli sforzi di prevenzione e controllo del cancro al seno. La prima osservazione è che le donne con TNBC hanno un profilo di rischio riproduttivo distinto rispetto a tutti gli altri sottotipi. Un po’ sorprendentemente, gli altri sottotipi, compresi i sottotipi HER2, condividono profili di rischio riproduttivo simili. Queste osservazioni rafforzano l’idea che la TNBC sia una malattia distinta con un’eziologia unica. I fattori di rischio specifici di TNBC identificati includono un persistente aumento del rischio con la parità; una relazione interessante tra l’età avanzata alla prima gravidanza e il ridotto rischio di TNBC; e l’osservazione che l’allattamento al seno mitiga il rischio di TNBC, mentre l’allattamento al seno è inefficace o solo modestamente protettivo per tutti gli altri sottotipi. La ricerca si è concentrata sulla comprensione dell’eziologia unica di TNBC e su come l’interfaccia della parità e dell’allattamento al seno con il rischio per TNBC abbia il potenziale per ridurre sostanzialmente il carico della mortalità per cancro al seno. Ad esempio, la lunga coda dell’aumento del rischio di TNBC associato al parto suggerisce un processo di inizio della malattia, mentre l’aumento del rischio di breve durata per i sottotipi luminali è coerente con il recente parto che promuove la malattia preesistente. I modelli rodittori che distinguono tra l’inizio del tumore e la progressione possono fornire le informazioni necessarie per ridurre efficacemente l’incidenza di TNBC. Inoltre, i risultati relativi all’allattamento al seno e alla riduzione del rischio di TNBC offrono ulteriori prove degli effetti benefici sulla salute dell’allattamento al seno per la madre e il bambino; le politiche legislative e i programmi di salute pubblica che supportano la fattibilità dell’allattamento al seno per le nuove madri possono comportare una ridotta incidenza di TNBC.
ontributo : intervista al Dott. Ruggero Ridolfi, Medico Oncologo ed Endocrinologo Già Direttore UO “Immunoterapia e Terapia Cellulare Somatica” IRST IRCCS Meldola FC e coordinatore ISDE Sezione Forlì-Cesena
La Prevenzione Primaria, questa sconosciuta..
Rispetto all’inizio degli anni 2000, i cambiamenti climatici, l’epidemia, le
Perché, secondo lei, non si approfondiscono più le cause delle patologie tumorali?
Con i cambiamenti epocali iniziati o intensificatesi negli ultimi 4-5 anni e con la sperequazione economica che ne è conseguita, la tensione a scoprire le cause dei tumori per poterle poi rimuoveresi è affievolita
Non essendo stato adeguatamente finanziato e protetto negli ultimi decenni, il nostro SistemaSanitario appare
Che cosa ha fatto il Parlamento Europeo per ovviare a questa problematica?
Il Parlamento Europeo ha
È di questi giorni la decisione della Commissione Europea di ritirare la
Qual è la situazione in Italia per quanto riguarda la diffusione dei tumori?
In Italia l’incidenza della maggioranza dei tumori continua a crescere: +1,4% nei maschi e +0,7% nelle femmine (2022 vs 2023) e l’esposizione agli inquinanti atmosferici (PM10, PM2,5, NO2 e O3) causa ogni anno un grande numero di morti premature (oltre 63.000) e di anni di vita persi. Uno studio delle Università di Bologna e Bari con il CNR (Centro Nazionale Ricerche,) che si è avvalso dell’intelligenza artificiale, pubblicato nel gennaio 2023, ha dimostrato che in Italia la più elevata mortalità per cancro si registra là dove è maggiore l’inquinamento (atmosferico ed ambientale), anche se in quella stessa area gli “stili di vita” sono quelli più salubri. È una conferma di una vasta letteratura, già esistente da anni, che indica l’inquinamento dell’aria, dell’acqua e del cibo come causa principale della maggioranza dei tumori. I miei Colleghi Oncologi, però, non ne sembrano convinti e continuano ad indicare come prioritarie per la prevenzione del cancro la corretta alimentazione, l’attività fisica e i corretti stili di vita relegando l’inquinamento ambientale nelle ultime posizioni della lista.
Il Sistema Sanitario è in affanno, le indicazioni di Oncologi e Genetisti lasciano molto perplessi e i balbettii della Comunità Europea prevedono limiti da rispettare a lungo termine.
In sintesi: cosa si sente di rispondere a chi afferma che non si capisce il motivo per cui c’è stata una costante crescita delle patologie tumorali in Italia e nel mondo?
Si possono riassumere i seguenti punti:
- in Italia l’incidenza della maggioranza dei tumori continua a crescere
- gli oncologi continuano ad indicare i corretti stili di vita e l’attività fisica come prioritari per la prevenzione del cancro anche se, seguendo queste indicazioni, l’incidenza non
è andata migliorando negli ultimi 20 anni (lotta contro il fumo a parte).
- i genetisti chiedono di rendere più accessibili i test genetici (prodotti dalle companies) per identificare le persone sane con mutazione dei geni BRCA1- 2, al fine di valutare la sorveglianza intensiva ed anche eventuali interventi chirurgici profilattici per prevenire, forse, qualche centinaio di neoplasie rispetto alle 390.000 diagnosticate ogni anno.
- una vasta letteratura scientifica ed un recente studio condotto con Intelligenza Artificiale dimostrano che la causa principale dei tumori in Italia è l’inquinamento ambientale (in particolare quello dell’aria a cui si somma quello per i pesticidi)
- il Parlamento Europeo emette Direttive buone ma le cui applicazioni sono rimandate … a date da destinarsi.
- il Sistema Sanitario Italiano, già ultimo da almeno 15 anni per la spesa sanitaria pro-capite in Europa, è in sofferenza, con una deriva che sembra avviarsi verso il privato.
- Io penso che fino a quando il Prodotto Interno Lordo (PIL) valuterà solo riscontri economici e non il benessere o la salute dei cittadini.… la Prevenzione Primaria resterà un sogno e…l’incidenza dei tumori continuerà a crescere!