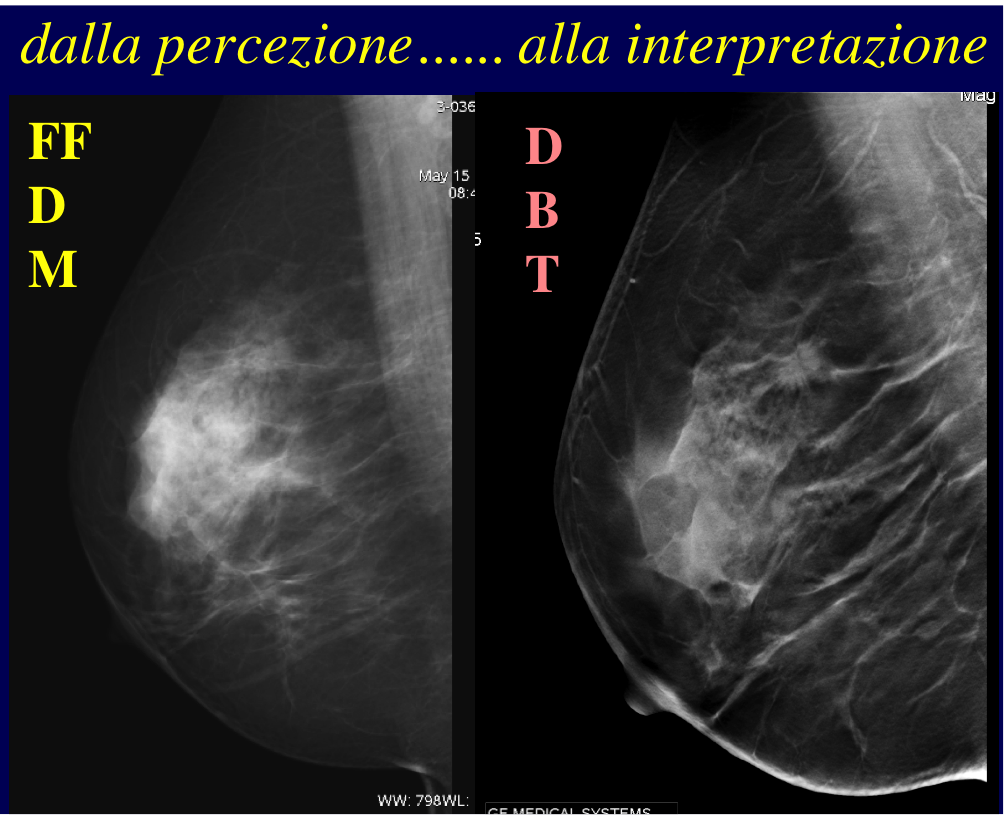
Non tutte le donne hanno lo stesso rischio! Non tutti i seni sono uguali!
La diagnosi precoce del tumore della mammella salva vite umane ma vi sono problemi insoluti, in particolare la sovradiagnosi, il sovratrattamento e i carcinomi d’intervallo. C’è bisogno di screening personalizzato…
Gli screening sono stati studiati a livello di popolazione e sono stati trovati efficaci, c’è bisogno però di personalizzazione. I benefici della mammografia sono noti, ma alcune donne potrebbero aver bisogno di uno screening aggiuntivo se hanno una marcata densità mammaria . Per determinare lo strumento di screening ottimale, dovremmo dialogare con la paziente e conoscere la sua storia personale – non possiamo fare una dichiarazione generale che tutti dovrebbero ottenere questo o quello. È impraticabile dire, ad esempio, che una risonanza magnetica è il miglior test, quindi tutti dovrebbero farla.
Gli screening mammografici hanno ottenuto una riduzione del 20% della mortalità specifica per cancro al seno nelle donne di età compresa tra i 50-74 anni grazie all’esecuzione della mammografia in due proiezioni ogni due anni. Nei programmi di screening consolidati tutte le donne eseguono lo stesso test. Dati di letteratura consolidati consigliano di abbassare l’età delle donne da 50 ai 45 anni. I risultati falsi positivi possono portare a test e stress inutili. Tutti dovrebbero fare una mammografia, ma uno screening aggiuntivo dovrebbe essere basato sul rischio personale. Secondo la U S Preventive Services Task Force, il numero di decessi per cancro al seno evitati dallo screening e dal trattamento precoce aumenta con l’età: in un periodo di 10 anni, lo screening di 10.000 donne di 60-69 anni comporterà 21 morti in meno per cancro al seno; 8 morti in meno in 10.000 donne 50-59 anni; e 3 morti in meno in 10.000 donne 40-49 anni.
Il rischio nel corso della vita di una donna che viene diagnosticato un cancro al seno è del 12,9%, più di 1 su 8. A causa dell’entità della malattia, del suo impatto psicosociale e della morbilità e mortalità associate, lo screening per la diagnosi precoce costituisce una parte fondamentale della lotta contro questo cancro.
La diffusione e l’importanza del cancro al seno è comprovata dal fatto che esso rappresenta il 29% di tutte le diagnosi oncologiche della popolazione femminile italiana, per la quale un tumore maligno su tre è un tumore mammario. In Italia, al giorno d’oggi, una donna su otto si ammala di tumore alla mammella nel corso della sua vita, con un’incidenza di circa 55.000 nuovi casi ogni anno e una prevalenza di 522.235 donne, dunque 1.869 donne ogni 100.000 residenti.

La prevenzione secondaria si focalizza su una diagnosi tempestiva e precoce della malattia, altamente consigliata a tutte le donne sopra i 40 anni, non solo in caso di predisposizione di una paziente allo sviluppo di un tumore al seno per fattori genetici ed epidemiologici, quali familiarità, assenza di gravidanze o gravidanze sopra ai 30 anni di età, menopausa tardiva o prima mestruazione precoce, scarso o assente allattamento al seno (AIRC, 2015). Diagnosticare il tumore in una fase ancora iniziale di sviluppo, permette di intervenire su carcinomi di piccole dimensioni e di garantire così al paziente una maggiore probabilità di guarigione completa attraverso cure meno impattanti. Dalla fine degli anni ’80, sono stati introdotti programmi organizzati di screening mammografico in un numero sempre maggiore di Paesi europei, sulla base dei risultati di otto grandi studi randomizzati. L’obiettivo dello screening mammografico è quello di individuare il cancro al seno il più presto possibile, soprattutto per ridurre il numero di decessi , ma anche per ridurre la gravità della malattia e l’utilizzo di trattamenti oncologici aggressivi (e dell’ansia ad essi associata).
Sulla base delle indicazioni che saranno formulate a livello europeo e nazionale e dopo il raggiungimento dei target di estensione e di adesione previsti dal quadro normativo e dispositivo nazionale si potrà prevedere
l’allargamento dello screening mammografico alla popolazione femminile in età compresa tra 45 e 49 anni e tra 70 e 74 anni ̋. La mammografia può essere usata per lo screening ed è quindi raccomandata e offerta gratuitamente in Italia a tutte le donne nella fascia di età tra i 50 e i 69 anni. Alcune Regioni, su indicazione del Ministero della Salute, la stanno estendendo alle donne tra i 45 e 49 anni con intervallo annuale e alle tra i 70 e 74 anni con intervallo biennale). Questi programmi hanno sempre utilizzato una strategia “unica” in cui le donne di uno specifico gruppo target sono invitate per una mammografia (2 radiografie bilaterali del seno) ogni 2 anni. Questo approccio ha dimostrato i suoi benefici (riduzione del 20% della mortalità specifica per il cancro al seno). Gli screening mammografici consentono: Migliore prognosi •Trattamenti conservativi •Rassicurazione casi negativi •Riduzione dei costi per la terapia delle forme avanzate. Tuttavia, portano anche alcuni effetti collaterali, come i risultati falsi positivi, sovradiagnosi e sovratrattamenti – vale a dire il trattamento dei tumori indolenti (quelli che non avrebbero mai causato problemi durante la vita di una donna perché sarebbe evoluti molto lentamente), e un basso rischio di cancro indotto dalle radiazioni per tutta la vita. La sovradiagnosi determina oggi quasi necessariamente un sovratrattamento.
Svantaggi screening mammografico
•Prolungata coscienza di malattia •Sovradiagnosi e sovratrattamento
•Falsa rassicurazione nei casi “falsi negativi ”
•Induzione di ansia nei casi “falsi positivi”
•Interventi non necessari nei casi falsi positivi
•Fastidio e dolore per l’esame mammografico
•Possibile rischio da radiazioni •Costi del programma di screening
Sovradiagnosi
Diagnosi di una lesione tumorale che, seppur confermata istologicamente, non sarebbe stata diagnosticata nel corso della vita del soggetto in assenza di screening”
E’ la combinazione di due cause:
1. la storia naturale della neoplasia (scarsa o nessuna progressività di certe lesioni)
2. la presenza di rischi competitivi di morte (tale che il soggetto morirà per un’altra causa prima che il tumore possa comparire clinicamente)
Paci and Duffy, Breast Cancer Research, 2005
L’unico modo per ridurre il sovratrattamento che consegue alla sovradiagnosi è riuscire a quantificare il potenziale aggressivo dei tumori ed adottare una politica di osservazione per i tumori a basso potenziale aggressivo. E’ possibile avere un sovratrattamento anche in assenza di sovradiagnosi ad es. in caso di terapie aggressive non necessarie a tumori ‘reali e progressivi’, che però sono ancora ad uno stadio molto precoce.
Se un esame è proposto a tutte le persone in una certa fascia di età e con particolari caratteristiche, si dice che è un esame di screening, cioè non basato sulle caratteristiche del singolo individuo o sulla sua storia familiare, ma su elementi condivisi dall’intero gruppo (per esempio, persone dello stesso genere e di una certa fascia di età).
Uno degli elementi importanti perché un test possa diventare uno screening è che incida sulla mortalità per la malattia che diagnostica: non basta fare più diagnosi, bisogna che queste diagnosi anticipate permettano di salvare vite umane cambiando il naturale decorso della malattia. Inoltre, la sensibilità dell’attuale screening mammografico non è perfetta, e il suo impatto sulla mortalità non è così elevato come si potrebbe pensare. Ciò non significa, però, che non vi siano donne che hanno bisogno di fare la mammografia anche in età più giovanile, per esempio se hanno familiarità per il cancro al seno oppure perché hanno una mammella con alcune caratteristiche particolari che, sulla base degli studi condotti finora, possono favorire la comparsa di un tumore. Nel loro caso non si parla però di screening, perché non rientrano nella categoria generale, ma di esami diagnostici prescritti sulla base di caratteristiche individuali. Nella strategia attualmente utilizzata, tutte le donne invitate alla mammografia sono trattate allo stesso modo. Ma le donne non sono tutte uguali: ogni donna ha un rischio diverso di sviluppare il tumore al seno, che dipende da fattori genetici, stile di vita, densità ed esposizione a ormoni. Il metodo di screening dovrebbe essere basato anche sul rischio individuale.
“Il nostro modello potrebbe essere considerato una chiave per la progettazione di screening personalizzato volto a ridurre i danni e aumentare i benefici dello screening mammografico”
A qualcuno a basso rischio “potrebbe essere offerto lo screening con mammografia standard ogni 3 o 4 anni invece di 2 anni”, ha spiegato Louro.
“A qualcuno a rischio medio potrebbe essere offerto lo screening con mammografia 3D avanzata ogni 3 anni, mentre a quelli ad alto rischio potrebbe essere offerto un nuovo test di screening con mammografia o risonanza magnetica ogni anno”.
Per sviluppare un nuovo modello, Louro e colleghi hanno condotto uno studio retrospettivo su 57.411 donne sottoposte a mammografia in quattro contee della Norvegia tra il 2007 e il 2019 come parte del programma BreastScreen Norway e le hanno seguire fino al 2022.
Il team ha raccolto dati su età, densità mammaria, storia familiare di cancro al seno, indice di massa corporea, età al menarca, abitudine all’alcol, esercizio fisico, gravidanza, terapia ormonale sostitutiva, malattia benigna del seno e ha confrontato le donne con diagnosi di tumore al seno e quelle senza diagnosi di cancro al seno.
Nel complesso, il rischio di cancro al seno a 4 anni previsto dal modello risultante variava tra i partecipanti, dallo 0,22% al 7,43%, con una mediana dell’1,10%.
Il maggiore effetto sul rischio è stato la densità del seno nella mammografia. Le donne con seni densi erano a rischio molto più elevato: il rapporto di rischio aggiustato era 1,71 per le donne con Volpara Density Grade 4 vs Grade 2 ed era di 1,37 rispetto al Grade 3.
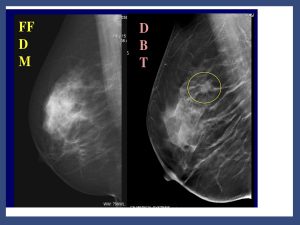
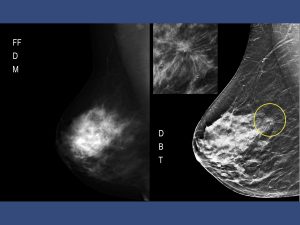
Un approccio promettente per migliorare lo screening mammografico è lo screening personalizzato, basato sul rischio individuale. In pratica uno screening che utilizza la stratificazione della popolazione target per fornire strategie, tempistiche e test di screening diversificati in base al rischio di sviluppare un determinato tumore
La stima del rischio individuale è calcolata in base alla propria storia clinica, all’anamnesi, alla densità del seno, allo studio dei polimorfismi genetici ed allo stile di vita ed alimentare.
La densità del seno è oggi un marker di rischio riconosciuto sia per quello che viene chiamato “effetto masking” (cioè il tumore, in questi casi, è oscurato dalla densa struttura del seno, cioè il tumore non si vede) sia, di per sé, come indicatore del rischio futuro. La valutazione di una numerosa coorte di donne del programma di screening a Firenze da parte di Ispro (Puliti et al.,BCR, 2018), ha confermato il valore di una adeguata classificazione della densità (studiata con software dedicato) per definire il rischio individuale ma non ha analizzato l’effetto combinato della densità e dei richiami, invasivi o no. Sarebbe utile approfondire, anche con altri studi nella realtà italiana, e valutare se esiste la possibilità di tenerne conto nel regime di screening.
Lavorare in questa direzione è importante, ma non si dovrebbe sottovalutare anche l’opportunità di identificare le donne a minore probabilità di un futuro tumore al seno (basso rischio). Una questione con forti implicazioni considerando la necessità di ridurre i test di screening nell’arco della vita, alla luce della possibile relazione tra sovradiagnosi (per esempio forme in situ o a bassa aggressività) e sovratrattamento con l’intensità di screening mammografico. Questa era l’ipotesi di uno studio randomizzato, tuttora in corso ma che ha avuto purtroppo problemi nel reclutamento, lo studio Tailored Breast Screning Trial (TBST), che valuta la densità alla mammografia, ed assegna in modo random a un intervallo di 2 anni le donne 45-49enni che normalmente, in quella fascia di età, sono reinvitate a un anno. Una opportunità di personalizzazione del protocollo di screening che i dati osservazionali esistenti in alcune regioni potrebbero, forse, già consentire di valutare.
I fattori di rischio legati agli stili di vita sono infatti modificabili e l’adozione di un corretto stile di vita può contribuire ad una diminuzione del livello di rischio individuale.
I recenti progressi scientifici hanno migliorato in maniera significativa la nostra comprensione della genetica del tumore al seno e di altri fattori di rischio come la densità e lo stile di vita. Siamo in possesso di strumenti migliori di valutazione dei rischi e di conoscenze sufficienti per studiare i benefici portati alle donne dall’utilizzo di un calcolo del rischio individuale di tumore al seno.
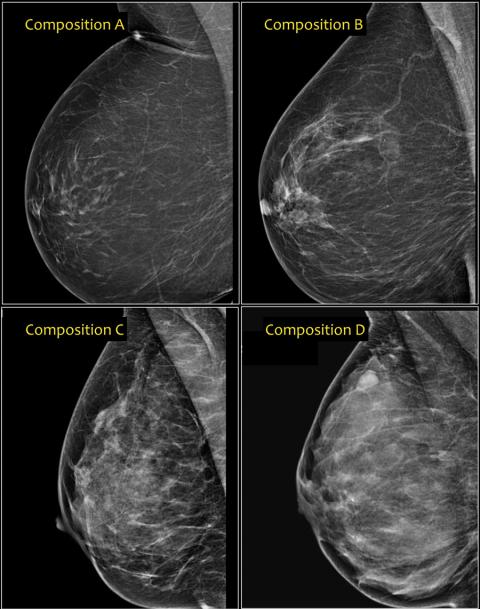
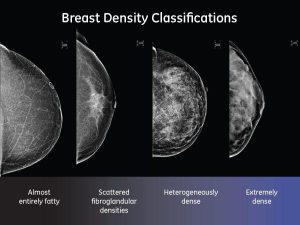
La densità del seno è una misura utilizzata per descrivere la proporzione dei diversi tessuti che compongono il seno di una donna. I seni sono costituiti di grasso, tessuto ghiandolare e tessuto connettivo. L’elevata densità del seno significa che esiste una percentuale maggiore di tessuto ghiandolare e connettivo rispetto al grasso. La densità del seno viene misurata con la mammografia. I radio-senologi classificano la densità mammaria usando una scala di densità a 4 livelli, con il livello 3 che indica seni eterogenei e il livello 4 che indica seni estremamente densi Esempi di ciascuna categoria di composizione del tessuto mammario:
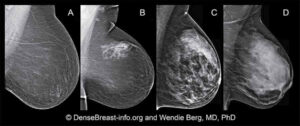
(a) prevalentemente adiposo; (b) a densità fibroghiandolare sparsa; (c) eterogeneamente denso, tessuto che può impedire la rilevazione di piccole masse; (d) tessuto estremamente denso che riduce la sensibilità della mammografia.
Il seno denso, contenente più ghiandola che tessuto adiposo, è un fattore di rischio indipendente e non modificabile per il cancro al seno e può mascherare il cancro sulle mammografie. La mammografia di screening lo rileva nel 40%-50% delle donne. La densità del seno è una misura utilizzata per descrivere la proporzione dei diversi tessuti che compongono il seno di una donna. La maggiore densità del seno oltre che determinare una riduzione del Valore Predittivo Negativo (VPN) della mammografia, è associata ad un aumentato rischio di sviluppare il cancro al seno. Secondo recenti statistiche, le donne con un seno estremamente denso hanno il doppio del rischio di sviluppare il cancro al seno rispetto alle donne con una densità media del seno. Rispetto alle donne con tessuto adiposo sul seno, le donne con tessuto denso hanno un rischio aumentato da 4 a 6 volte di carcinoma mammario.
Uno studio qualitativo sulle donne in età da screening del cancro al seno ha scoperto che poche donne hanno identificato la densità del seno come un fattore di rischio per il cancro al seno.La maggior parte delle donne non si sentiva sicura di sapere quali azioni avrebbero potuto mitigare il rischio di cancro al seno, portando i ricercatori alla conclusione che è necessaria un’educazione completa sui rischi del cancro al seno e sulle strategie di prevenzione. Lo studio è stato pubblicato all’inizio di quest’anno su JAMA Network Open.[ 1]
“Dal 40 al 50% delle donne sottoposte a mammografia rientrano nelle due più alte categorie di densità al seno”, ha detto una delle autrici dello studio, Christine Gunn, PhD, del Dartmouth Institute for Health Policy and Clinical Practice, New Hampshire “Il rischio di cancro al seno aumenta da 1,2-4,0 volte a seconda del livello di densità del seno. In confronto, una storia familiare di primo grado di cancro al seno, in particolare nelle donne in premenopausa, conferisce un rischio di cancro al seno due volte superiore”.
I medici devono informare i pazienti per iscritto
Il tessuto mammario rientra in 1 delle 4 categorie: tessuto adiposo, aree sparse di tessuto fibroglandulare denso, molte aree di tessuto ghiandolare e connettivo o tessuto estremamente denso. Nel seno denso è più difficile trovare i tumori perché il tessuto connettivo appare opaco sulla mammografia, mascherando i tumori.
Ai sensi del Mammography Quality Standards Act,[2] che è stato aggiornato il 10 marzo, la FDA richiede che ai pazienti venga fornito un riepilogo del rapporto mammografico che “identifica se il paziente ha tessuto mammario denso o non denso”.
La maggiore densità del seno oltre che determinare una riduzione del Valore Predittivo Negativo (VPN) della mammografia, è associata ad un aumentato rischio di sviluppare il cancro al seno. Secondo recenti statistiche, le donne con un seno estremamente denso hanno il doppio del rischio di sviluppare il cancro al seno rispetto alle donne con una densità media del seno. Rispetto alle donne con tessuto adiposo sul seno, le donne con tessuto denso hanno un rischio aumentato da 4 a 6 volte di carcinoma mammario. La densità del seno è un fattore limitante per la rilevazione del carcinoma mammario mediante mammografia poiché il tessuto mammario denso, come i noduli potenzialmente cancerosi o benigni, appare bianco sulla mammografia. La densità è un personale fattore di rischio, principale causa dei cancri di intervallo. La densità oltre ad essere un fattore di mascheramento è un fattore di rischio per lo sviluppo di un tumore della mammella. I limiti della mammografia per la rilevazione del cancro tra le donne con seno denso hanno portato almeno 22 stati degli Stati Uniti a emanare una legislazione che impone ai radiologi di informare i pazienti sulla densità del seno e indicare la possibile necessità di imaging supplementare.Il rapporto, che dovrebbe essere scritto in linguaggio comprensibile, dovrebbe anche specificare il “significato” del tessuto denso.
Anche se alcuni stati impongono la notifica indipendentemente dal livello di densità, la maggior parte notifica le donne solo se è stato identificato un tessuto eterogeneamente denso o estremamente denso. In alcune strutture del Massachusetts, ad esempio, le donne possono ricevere una lettera di relazione sulla mammografia e una lettera separata sulla densità del seno. “Per alcuni, è stato davvero confuso. Hanno ricevuto una lettera che diceva che la loro mammografia era normale e poi un’altra che diceva che hanno un seno denso — con conseguente molta incertezza e ansia. Non vogliamo allarmare eccessivamente le persone. Vogliamo che capiscano il loro rischio”, ha detto. La densità del seno può essere considerata tra gli altri fattori di rischio, tra cui l’uso di alcol, l’obesità, la dieta, la parità, la precedente biopsia del seno e le mutazioni genetiche sfavorevoli ereditarie.
“Se il rischio totale per tutta la vita è superiore al 20%, si aprono ulteriori opzioni di screening, come una risonanza magnetica del seno, che catturerà più tumori di una mammografia del seno da sola”, ha detto Gunn. “La sfida per i medici e i pazienti è la raccolta e la comprensione delle informazioni sulla densità del seno nel contesto di altri fattori di rischio Idealmente, un radio-senologo potrebbe e dovrebbe consegnare i risultati alla paziente in tempo reale alla fine della visita alla mammografia, integrando con ecografia in caso di seno denso formulando raccomandazioni in base alle stime del rischio. In base alla densità andrebbero definite l’intervallo di esecuzione dell’esame e gli esami supplementari come l’ecografia e La RM o la mammografia con il contrasto.
 Negli Stati Uniti il coinvolgimento delle associazioni femminili ha condizionato il legislatore a tal punto che per legge si impone la notifica della densità mammaria in mammografia. La misura della densità può essere ottenuta mediante software diversi o stimata dal radiologo. Fermo restando che se si vuole personalizzare, la presenza del radio-senologo mentre si esegue la mammografia è fondamentale in particolare nel seno denso per praticare l’imaging supplementare. Lo screening mammografico dovrebbe essere differenziato ogni due anni nei seni a densità a e b , ogni anno nei seni a densità c e d. E’ auspicabile l’avvio di studi che mettano a confronto l’attuale strategia standard di screening mammografico con una strategia personalizzata, che esamina le donne con un alto rischio di cancro al seno con maggiore frequenza, e le donne con rischio più basso con minore frequenza. Per rispondere ad una semplice, ma fondamentale domanda: è meglio personalizzare il metodo e la frequenza dello screening mammografico in base al rischio individuale.
Negli Stati Uniti il coinvolgimento delle associazioni femminili ha condizionato il legislatore a tal punto che per legge si impone la notifica della densità mammaria in mammografia. La misura della densità può essere ottenuta mediante software diversi o stimata dal radiologo. Fermo restando che se si vuole personalizzare, la presenza del radio-senologo mentre si esegue la mammografia è fondamentale in particolare nel seno denso per praticare l’imaging supplementare. Lo screening mammografico dovrebbe essere differenziato ogni due anni nei seni a densità a e b , ogni anno nei seni a densità c e d. E’ auspicabile l’avvio di studi che mettano a confronto l’attuale strategia standard di screening mammografico con una strategia personalizzata, che esamina le donne con un alto rischio di cancro al seno con maggiore frequenza, e le donne con rischio più basso con minore frequenza. Per rispondere ad una semplice, ma fondamentale domanda: è meglio personalizzare il metodo e la frequenza dello screening mammografico in base al rischio individuale.
Le donne non sono tutte uguali ed i seni non sono tutti uguali: ogni donna ha un rischio diverso di sviluppare il tumore che dipende non solo dall’età ma anche dalla familiarità, dalla densità del seno, dagli stili di vita (stile alimentare, sedentarietà) e anche da fattori genetici. A nostro giudizio per capire se alla donna serva eseguire la tomosintesi, con o senza ecografia, annualmente oppure ogni due anni bisognerebbe valutare:
- Calcolo della densità con software dedicato: il seno a densità eterogenea o a densità elevata c e d. In questi casi serve la tomosintesi e l’ecografia.
- Valutazione della familiarità e studio dei fattori genetici.
- Valutazione dello stile di vita, dello stile alimentare, del sovrappeso e della sedentarietà.
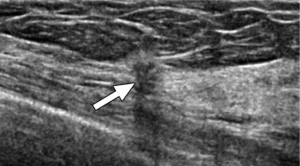
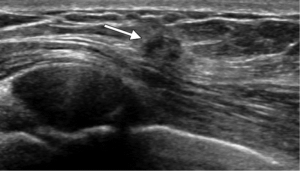
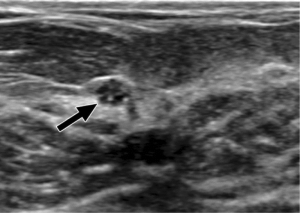
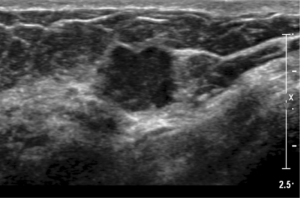
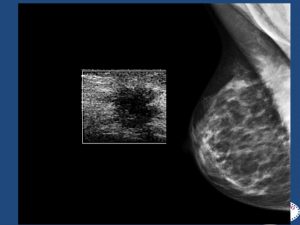
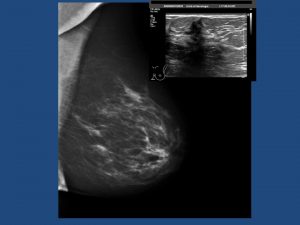 Quadri mammografici ed ecografici
Quadri mammografici ed ecografici


L’esercizio fisico ha un grande impatto sul rischio di cancro al seno.Le donne che si sono esercitate per 4 o più ore alla settimana avevano un rapporto di rischio aggiustato di 0,65 per il rischio di cancro al seno rispetto alle donne che non si sono mai esercitate. Anche se questo effetto dell’esercizio fisico che riduce il rischio di cancro al seno è ora ampiamente noto, di solito non è incluso nei modelli che prevedono il rischio di cancro al seno, ha sottolineato il team.

Uno stile di vita sedentario è già stato collegato ad un aumentato rischio di cancro al seno ma un nuovo studio ha fornito prove più forti di causalità. I risultati dimostrano che l’attività fisica e la riduzione del tempo di sedentarietà sono raccomandati per la prevenzione del cancro. “Il nostro studio aggiunge ulteriori prove che cambiamenti comportamentali possano ridurre l’incidenza dei tassi di cancro al seno”, Suzanne C. Dixon-Suen, Phd, del Cancer Council Victoria, Melbourne, Austrialia.
Esisterebbero spiegazioni biologiche con prove convincenti che suggeriscono percorsi causali tra attività fisica e rischio di cancro al seno tra cui sovrappeso e obesità, sindrome metabolica, ormoni sessuali e infiammazione.
Il team ha concluso che il loro modello di previsione potrebbe essere utilizzato per personalizzare lo screening del seno per le donne in base alla loro valutazione del rischio, anche se riconoscono che è necessario più lavoro. Questo lavoro si basa su un programma di screening in un paese e sono necessari studi simili in contesti diversi.
Commentando i risultati, Laura Biganzoli, MD, copresidente della Conferenza europea sul cancro al seno e direttrice del Centro per l’allattamento al seno presso l’ospedale Santo Stefano, Prato, Italia, ha commentato: “Sappiamo che i programmi di screening del seno sono utili, ma sappiamo anche che alcune persone subiranno potenziali danni causati da falsi positivi o sovradiagnosi”.
Studi controllati e randomizzati dovranno mettere a confronto due gruppi di donne: un gruppo che segue l’attuale strategia standard di screening mammografico, e un gruppo che seguirà una strategia di screening personalizzato basato sul rischio. La mammografia da sola potrebbe non essere sufficiente per diagnosticare il tumore al seno nelle mammelle con tessuto mammario denso. Solo personalizzando si può migliorare la cancer detection rate (CDR) riducendo i falsi negativi e quindi i cancri d’intervallo.
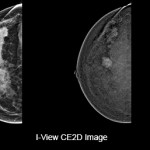
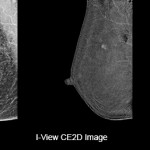
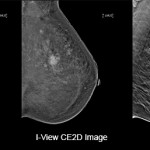
Mammografia con mezzo di contrasto (CEM)
Il tumore del seno è caratterizzato prevalentemente da un’area di nuova formazione di vasi (neoangiogenesi), pertanto la possibilità di evidenziare e studiare la presenza di queste aree è importante ai fini diagnostici”.
Questo esame – molto veloce e ben tollerato dalle pazienti – permette di escludere completamente tutte le patologie benigne e di evidenziare solo le aree interessate dalla neoplasia. Come ormai dimostrato in letteratura da numerosi studi, la mammografia con mezzo di contrasto ha le stesse indicazioni e possibilità diagnostiche della risonanza magnetica.
Alla paziente viene somministrato mezzo di contrasto iodato non ionico in vena. A due minuti dalla iniezione del contrasto, si esegue una mammografia standard, in piedi o seduta. L’esame si svolge in 8 massimo 10 minuti come per una mammografia senza mezzo di contrasto. E’ la “macchina” che esegue successivamente tutte le elaborazioni delle immagini ottenute, effettua tecnicamente una sottrazione spettrale, per cui cancella tutto quello che non interessa e mette in evidenza esclusivamente le aree vascolari dove si è concentrato il mezzo di contrasto, aree che dovrebbero corrispondere alla lesione”.
La mammografia con mezzo di contrasto, CEM è la più recente delle tecniche diagnostiche introdotte in senologia. Dopo due minuti dalla somministrazione del mezzo di contrasto iodato avvengono le acquisizioni nelle due nelle due proiezioni mammografiche standard. Per ogni compressione l’apparecchio acquisisce prima una proiezione a bassa energia e poi una ad alta energia. Un algoritmo fornisce l’immagine sottratta o ricombinata in cui sono visualizzate solo le aree di accumulo del mezzo di contrasto mentre le normali strutture tissutali mammarie vengono sottratte. La CEM risulta sovrapponibile in termini di sensibilità e specificità alla risonanza magnetica.

Documento SIRM 2022
Statement sull’uso della Mammografia con MdC (CEM) in Italia, a cura della Sezione di Studio di Senologia della Società Italiana di Radiologia Medica e Interventistica Massimo Calabrese, Stefania Montemezzi, Gianfranco Paride Scaperrotta, Valentina Iotti, Maria Adele Marino, Giuseppe Di Giulio, Marco Moschetta, Giulia Bicchierai
Lo screening mammografico si è dimostrato efficace nel diagnosticare il cancro al seno in una fase precoce e nel ridurre la mortalità per tumore al seno.
Circa il 20% dei tumori mammari non viene diagnosticata alla mammografia e il 10% delle donne viene richiamato per esami aggiuntivi. Le due principali limitazioni della mammografia sono, infatti, la ridotta sensibilità nei seni densi, dove questa si riduce dal 70-75% al 30-48%, e la percentuale relativamente elevata di falsi positivi [2]. In questo contesto, l’introduzione della mammografia con mezzo di contrasto (generalmente indicata come CEM: Contrast-Enhanced Mammography [3]) ha l’obiettivo di superare parte di questi limiti della mammografia standard. La CEM è una metodica che combina le informazioni morfologiche della mammografia digitale e informazioni funzionali grazie all’utilizzo del mezzo di contrasto iodato iniettato per via endovenosa, che consente la valutazione della neoangiogenesi tumorale analogamente a quanto avviene con la risonanza magnetica (RM) con mezzo di contrasto endovenoso [4–6] . È una metodica sempre più diffusa, potenzialmente implementabile sulle unità mammografiche già presenti nei diversi contesti ambulatoriali e ospedalieri, che ha mostrato performance diagnostiche paragonabili alla RM [4–7] e a costi economici inferiori [8], riscontrando inoltre la preferenza delle pazienti perché caratterizzata da tempi di esecuzione inferiori, meno rumorosa e reputata meno ansiogena [9–11] .
Principi di funzionamento della mammografia con mezzo di contrasto.
La CEM è una metodica in grado di combinare la mammografia digitale con la somministrazione endovenosa di mezzo di contrasto iodato utilizzando la tecnica dual-energy (acquisizione consecutiva di immagini ad alta e a bassa energia) [12–16]. L’apparecchiatura necessaria è quella di un mammografo, implementato da uno specifico filtro (in titanio o rame) per l’acquisizione dell’immagine ad alta energia, e dal software di ricostruzione in post-processing per l’elaborazione delle immagini ai fini diagnostici. L’esecuzione dell’esame prevede lo stesso posizionamento di una mammografia standard, con mammella compressa nelle proiezioni cranio-caudale, laterale e medio-laterale-obliqua, con, eventualmente, compressioni mirate e ingrandimenti. Dopo la somministrazione endovenosa di mezzo di contrasto iodato, per ogni proiezione mammografica, il sistema acquisisce automaticamente in successione due immagini, una a bassa (26-33 kVp) e una ad alta energia (44-50 kVp, superiore al k edge dello iodio, ottenibile grazie all’utilizzo dei filtri in titanio o rame). Il tempo di acquisizione per ogni singola proiezione (e compressione) varia dai 2 ai 20 secondi a seconda dello spessore della mammella e del macchinario utilizzato [4]. Le immagini ottenute direttamente sono così due: un’immagine “a bassa energia” e una immagine ad “alta energia”. Quest’ultima non è utilizzabile con finalità diagnostica ma viene elaborata dal software dedicato in combinazione con l’immagine a bassa energia, permettendo di ottenere un’immagine “ricombinata” che evidenzia tutto quello che è dotato di impregnazione contrastografica, minimizzando il sovrapporsi del tessuto ghiandolare mammario. Le immagini diagnostiche della CEM sono dunque, per ogni proiezione mammografica, un’immagine “a bassa energia” del tutto sovrapponibile per semeiotica e accuratezza diagnostica ad una mammografia standard [17,18] , e un’immagine “ricombinata“ la cui valutazione dell’impregnazione contrastografica ricalca molte caratteristiche dell’analisi qualitativa della RM con mezzo di contrasto [19], e che sta affermandosi nell’analisi quantitativa grazie all’utilizzo di metodiche di radiomica [4,20–22]. La corretta analisi di un’indagine CEM tiene conto in modo imprescindibile della valutazione di entrambe le immagini diagnostiche, che contribuiscono ad una caratterizzazione sia morfologica che funzionale delle lesioni mammarie [23]. Protocollo di acquisizione Nonostante, al momento della stesura del documento, non ci sia concordanza nella comunità scientifica di univoci parametri ottimali per la CEM (concentrazione del mezzo di contrasto, dose, velocità di flusso, e intervallo tra somministrazione di mezzo di contrasto ed acquisizione delle immagini), nella pratica clinica si fa riferimento prevalentemente a quanto pubblicato nel 2009 da Dromain C et al [13]. La somministrazione endovenosa di mezzo di contrasto iodato richiede di seguire le stesse linee guida e accortezze già in vigore per gli studi di tomografia computerizzata (TC) [24]. Analogamente alla effettuazione di esami di RM della mammella con mezzo di contrasto, una questione ancora aperta rimane il timing dell’esame rispetto alla fase del ciclo mestruale: per evitare il sovrapporsi dell’impregnazione contrastografica parenchimale di fondo (background-parenchymal enhancement) alcuni studi raccomandano l’esecuzione dell’esame tra il quinto e il quattordicesimo giorno del ciclo mestruale [15,25]. La procedura, dopo la consueta raccolta del consenso informato all’esame con somministrazione endovenosa di mezzo di contrasto iodato, inizia con il reperimento di un accesso venoso periferico. La successiva somministrazione di mezzo di contrasto iodato può avvenire con tecnica manuale o, preferibilmente, utilizzando una pompa automatica di iniezione (ad una velocità di 2-3 ml/sec), seguita da un bolo di soluzione fisiologica. Considerando che il mezzo di contrasto iniettato presenta un tempo di visualizzazione di circa dieci minuti dopo somministrazione, in questo arco di tempo è possibile effettuare l’acquisizione delle immagini mammografiche. L’inizio dell’acquisizione avviene dopo 2 – 2.5 minuti dalla somministrazione, con l’indicazione di effettuare la sequenza delle proiezioni (CC-MLO) di entrambi i seni secondo pratica clinica, non essendone stata dimostrata una più efficace successione. Nei minuti rimanenti dopo l’acquisizione delle proiezioni standard, laddove necessario è possibile integrare l’esame con proiezioni aggiuntive (ingrandimenti o compressioni mirate). La presenza di protesi additive non costituisce una limitazione alla mammografia con contrasto che può essere effettuata ricorrendo alle classiche proiezioni di Eklund [26]. Il tempo totale di acquisizione dell’esame di mammografia con mezzo di contrasto è pertanto di circa 5-10 minuti (incluso il tempo di iniezione), simile a quello di una mammografia standard in 4 proiezioni, anche se il “room time” totale è leggermente superiore, legato al tempo di preparazione all’iniezione.
Dose radiante. La metodica dual-energy prevede intrinsecamente una doppia esposizione per ogni singola proiezione; pertanto, la dose radiante aumenta rispetto alla mammografia standard. L’esposizione a bassa energia presenta una dose radiante sovrapponibile a quella di una mammografia digitale, mentre quella ad alta energia ne è superiore, con un complessivo incremento della dose radiante riportato tra il 20% e l’80%, condizionato dal tipo di apparecchiatura utilizzata, dal settaggio del sistema e dallo spessore della mammella [4,15,27]. Tuttavia, questi valori rimangono al di sotto della soglia indicata dalle linee guida europee per la mammografia di screening [28] e dalle linee guida della Mammography Quality Standards Act [29], che sanciscono che l’aumento di dose non costituisce un significativo fattore di rischio sul lifetime risk. Indicazioni all’uso della mammografia con mezzo di contrasto
– Stadiazione preoperatoria: a oggi il più diffuso campo di applicazione della CEM, già ufficialmente riconosciuto nelle linee guida europee come metodica alternativa alla RM per la pianificazione dell’intervento chirurgico [28].
La CEM ha mostrato una elevata precisione sia nel misurare la lesione principale (con una differenza di diametro compresa tra 0,03 mm e 5 mm rispetto alla misura sul pezzo operatorio) [17,30,31], sia nell’identificare la multifocalità e multicentricità delle lesioni [32–34]. La principale limitazione della metodica in questo campo, paragonata alla RM, è l’impossibilità di un adeguato studio delle cavità ascellari a causa del campo di vista sovrapponibile a quello mammografico.
– Problem solving (richiami di screening e mammografie cliniche): in caso di discrepanza nell’imaging mammografico / tomosintesi, con i reperti clinici ed ecografici, sia nella pratica clinica che, soprattutto, nei richiami per reperto sospetto alla mammografia di screening. Quest’ultimo campo è stato uno dei primi di applicazione della CEM, giustificato dall’elevata prevalenza di cancri [4], che in letteratura ha mostrato una sensibilità compresa tra il 93% e il 100% e una specificità tra il 63% e l’88%, rappresentando un incremento del 5%-46% e del 3%-15% rispetto alla mammografia standard in termini di sensibilità e specificità, rispettivamente [32,35,36].
– Screening in donne a medio e alto rischio: nelle donne a rischio di sviluppare tumore alla mammella alto (lifetime risk >20%) e intermedio (lifetime risk 15-20%), che comprende l’eredo-familiarità, la storia personale di pregresso tumore mammario, l’elevata densità della mammella e la pregressa diagnosi di lesioni ad alto rischio. L’analisi della neoangiogenesi è di grande impatto nella “detection” tumorale, e numerosi protocolli di sorveglianza prevedono l’utilizzo della RM con mezzo di contrasto associata alla mammografia. In tale contesto la CEM è in grado di combinare in un unico esame sia la valutazione morfologica della mammografia che l’analisi della neo-angiogenesi, ed è potenzialmente più accessibile della RM, a oggi per lo più limitata alle sole pazienti ad alto rischio. I risultati in letteratura sono ancora iniziali e spesso condizionati dalla diversa definizione del rischio e dalle metodiche di imaging confrontate, ma molto promettenti [36–39]: in uno studio retrospettivo su 904 pazienti, la CEM ha mostrato una detection rate del 15,5‰, paragonabile alla RM [38,39]. Se paragonata alla mammografia standard, la CEM ha mostrato una migliore sensibilità (90,5% vs 52,4%), e una ridotta specificità (76,1% vs 90,5%); l’aggiunta dell’ecografia alla CEM non ha portato, in quel contesto, ad un significativo miglioramento della performance diagnostica, ma ad un potenziale aumento di biopsie non necessarie [37]. Rispetto alla RM, tuttavia, per le pazienti ad alto rischio (lifetime risk >20%) è necessario considerare come possibile limitazione della CEM la dose di radiazione incrementata rispetto alla mammografia standard, per quanto entro i limiti [28,29], in relazione all’aumentata radiosensibilità e conseguente possibilità di tumori radioindotti [40–43]. Data l’importanza di uno screening sempre più personalizzato e la complessa valutazione della stratificazione del rischio, nel Regno Unito è in corso un trial clinico randomizzato che prevede l’arruolamento di 13 200 donne con rischio aumentato in relazione alla densità ghiandolare mammaria, in cui la CEM è parte del protocollo di studio come metodica aggiuntiva alla mammografia di screening e confrontata con l’aggiunta di ecografia o di RM [BRAID][44].
– Diagnosi in donne sintomatiche: nel riscontro di masse palpabili, uno studio ha mostrato come l’utilizzo della CEM come prima metodica di indagine aumenti significativamente la sensibilità e specificità se confrontata con la sola mammografia digitale, rispettivamente del 95% (vs. 84%) e del 81% (vs. 63%) [45], senza che l’aggiunta dell’indagine ecografica alla CEM porti un significativo ulteriore incremento della “detection” tumorale, in particolare in donne con seno denso [46].
– Controllo della risposta alla chemioterapia neoadiuvante: nonostante siano ancora poco numerosi gli studi che valutano la performance diagnostica della CEM nell’individuare il residuo di malattia al termine della chemioterapia neo-adiuvante, una recente metanalisi [47] ha mostrato risultati molto promettenti, con una sensibilità pari all’80,7% (95% CI 65.5 – 90.2) e una specificità del 94% (95% CI 78.3 – 98.6). Se confrontata con la RM [48,49], a oggi metodica standard, la sensibilità relativa è stata di 1,15 in favore della CEM (95% CI 0.939 – 1.404; p=0.18) e la specificità relativa di 1.04 (95% CI 0.916 – 1.177; p=0.55). – Follow-up in pazienti operate (interventi conservativi): nel controllo annuale di queste pazienti la CEM ha recentemente mostrato una capacità di individuare lesioni tumorali (cancer detection rate) del 15,4‰ (rispetto al 6,2‰ della valutazione della sola immagine a bassa energia paragonabile alla mammografia digitale), con un valore predittivo positivo del 42,9% (rispetto al 37,5% dell’immagine a bassa energia), contribuendo con lo studio della vascolarizzazione a superare frequenti complessità strutturali morfologiche legate alla presenza di aree cicatriziali ed esiti post-attinici [50]. – Gestione dei B3: ruolo emergente della CEM è stato dimostrato nel management delle lesioni ad incerto potenziale maligno (lesioni B3) con benefici specialmente in quelle lesioni sottoposte a biopsia escissionale e non chirurgica in due studi preliminari [51,52]. Ulteriori trial clinici e prospettici sono necessari per validare questi risultati e confermare il possibile ruolo della CEM nella gestione delle lesioni B3. Analisi dei costi In base ai dati riportati sopra, la CEM si candida come alternativa alla RM mammaria con mezzo di contrasto per gran parte delle sue applicazioni, e come possibile alternativa alla mammografia digitale in alcuni contesti mirati (ad esempio per pazienti ad alto rischio, sintomatiche). Nell’effettuare un’analisi dei costi che metta a confronto CEM e RM con contrasto, è necessario considerare i costi di acquisto e gestione del macchinario (analogo ad un mammografo standard per la CEM), la potenziale differenza di disponibilità delle due metodiche e il costo per singolo esame: secondo uno studio pubblicato nel 2017 negli Stati Uniti, il costo di una RM mammaria con mezzo di contrasto è di circa 800$, mentre quello di un esame CEM di circa 200$ [9].
- Vantaggi della CEM rispetto alla RM –Breve durata dell’esame-Costo inferiore-Elevata risoluzione spaziale-Assenza di controindicazioni
- Indicazioni Screening nelle donne a rischio genetico e a densità mammografica elevata-Staging-Monitoraggio in chemioterapia neoadiuvante-Diagnosi differenziale tra cicatrice e recidive-Studio di pazienti sintomatiche- Approfondimento di casi dubbi alla mammografia
- Le principali limitazioni sono l’utilizzo di radiazioni , le possibili reazioni avverse al mezzo di contrasto, il campo di vista più limitato rispetto alla risonanza.
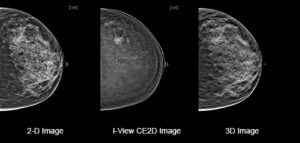
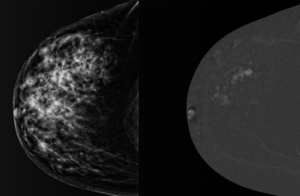
L’esame supplementare ecografico 3D automatizzato “ABUS” aiuta ad incrementare la diagnosi tempestiva del tumore al seno nelle donne con seno denso.
Screening del cancro al seno Invenia ABUS 2.0 sistema ecografico automatizzato.
Lo screening del cancro al seno co ABUS 2,0 viene eseguito in aggiunta alla mammografia ed è un esame confortevole che non utilizza le radiazioni. È stato sviluppato specificamente per lo screening dei seni densi. Chiedi al nostro servizio di senologia se lo screening mediante Invenia ABUS 2.0 ti possa giovare.
La densità del seno è classificata in una delle quattro categorie: A, B, C o D
Chiedi al tuo radio-senologo della tua densità mammaria: ogni donna dovrebbe essere consapevole della densità del proprio seno.
Sia il tessuto denso che il tumore possono apparire opachi su una mammografia, un esame Invenia ABUS 2.0 può aiutare a trovare quei tumori nascosti che si mascherano nella densità di base
All’interno di questo quadro così articolato in merito alle alternative diagnostiche per l’identificazione del tumore al seno, si intende valutare il potenziale ruolo dell’introduzione dello strumento diagnostico ABUS, basato su onde sonore per creare immagini 3D del tessuto mammario, indicato come una tecnologia aggiuntiva alla sola mammografia per l’effettuazione dello screening del tumore al seno, per donne asintomatiche, per le quali i risultati dell’esame mammografico siano normali o benigni, con parenchima mammario denso e senza precedenti interventi clinici al seno.Circa il 50% delle donne ha un tessuto mammario denso4, uno dei fattori di rischio più comune ed elevato per lo sviluppo del carcinoma mammario. La presenza di tessuto mammario denso aumenta la probabilità che una donna sviluppi un carcinoma mammario da quattro a sei volte6 e il settanta percento dei tumori alla mammella si riscontra in mammelle dense.
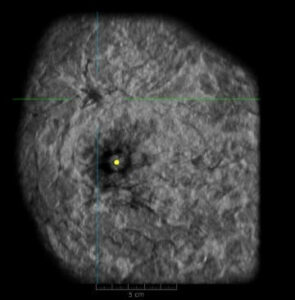
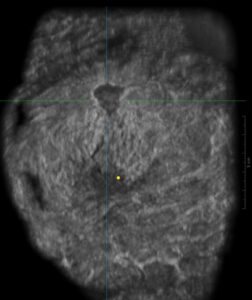
Stando agli ultimi dati disponibili, nei casi di tessuto mammario particolarmente denso, la mammografia tradizionale non riesce a rilevare oltre un terzo dei tumori ed è in questo scenario complesso che è nato ABUS (Automated Breast Ultrasound System).
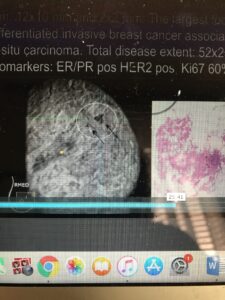
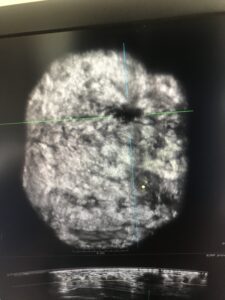
- Vantaggi del sistema ecografico automatizzato: Non è operatore-dipendente, Standardizzata, Riproducibile, Minore tempo di acquisizione, Utilizzo del piano coronale, Accuratezza nell’identificazione della retrazione
- Indicazioni: Screening nei seni densi-Staging preoperatorio-Multifocalità-Multicentralità-Bilateralità-Second look-Valutazione della risposta alla chemioterapia neo adiuvante
- ABUS meglio caratterizza il pattern nodulare, l’orientamento della lesione, la regolarità/irregolarità, la presenza di alone iperecogeno, la retrazione, la presenza di microcalcificazioni, la riduzione del fascio ultrasonico post acustico.
- L’architettura di ABUS si avvale di un innovativo sistema software per processare l’immagine, offrendo prestazioni di alta qualità nell’imaging della mammella, anche nel caso di significativa densità del tessuto. L’apparecchiatura fornisce un’immagine caratterizzata da notevole risoluzione, grazie all’elevata potenza di elaborazione e alla tecnologia proprietaria di formazione del fascio ultrasonoro che realizza la continua messa a fuoco di ogni pixel: ogni scansione 2D contribuisce, pertanto, alla realizzazione di dataset volumetrici esplorabili sul piano coronale.
L’aggiunta di ABUS allo screening mammario ha dimostrato un aumento nella rilevazione di cancri pari a 1.9 per 1.000 donne sottoposte a screening, raggiungendo un risultato di 7.3 cancri per 1.000 donne sottoposte a screening, rispetto ai 5.4 cancri ogni 1.000 soggetti, della sola mammografia (Brem et al., 2015). Oggi in Italia possono accedere al percorso di screening mammario le donne di età compresa tra i 50 e i 69 anni, il tutto attraverso un processo che garantisce una mammografia di controllo ogni 2 anni. Gli screening mammografici prendono in considerazione la suddetta fascia di età in quanto, a seguito della menopausa, i cancri al seno sono molto più frequenti e tale esame risulta essere estremamente efficace, ottenendo dunque per il Servizio Sanitario Nazionale il massimo ritorno dell’investimento economico. Se da un lato, quindi, si conferma che è ben nota e consolidata l’efficacia dell’attivazione di percorsi virtuosi di screening, quale sia il percorso personalizzato organizzativamente e gestionalmente migliore per le pazienti. Ad oggi non è un fattore ancora determinato e completamente chiaro l’approccio di screening nel 50% dei seni densi. Molto spesso la strutturazione interna all’azienda che garantisce il percorso di screening dipende dalle disponibilità interne della stessa, dalle differenti visioni proposte dai responsabili di questo processo o dalle forme organizzative peculiari e dalla tendenze esclusivamente economicistiche costi/benefici. Nonostante la consolidata rilevanza e la significatività dell’argomento, è indubbio il fatto che si possono prendere in considerazione e quindi analizzare le potenziali aree di miglioramento del percorso attualmente in essere, e affrontare quali siano le tecnologie da proporre per utilizzarle all’interno del percorso diagnostico terapeutico rivolto a questa problematica di salute, anche da un punto di vista economico, che affronti la questione con una prospettiva non solo di breve periodo (ovvero l’impatto economico dello screening in sé e per sé), ma anche di medio-lungo periodo, considerando le risorse assorbite dalle donne sottoposte a screening alle quali è stato diagnosticato il tumore. Obiettivo primario della ricerca è quello di comprendere se sia possibile definire il migliore percorso diagnostico per lo screening del tumore mammario, andando a comparare uno scenario alternativo che prenda in considerazione l’effettuazione di tomosintesi / di una ecografia e di un controllo con la tecnologia ABUS, per verificare l’eventuale verificarsi di cancri di intervallo.

Utilizza una qualità delle immagini notevole, la vista coronale e strumenti di interpretazione avanzati per esaminare in modo diverso il tessuto mammario denso per esami diagnostici e di screening aggiuntivi. Screening innovativo del cancro al seno La mammografia 2D e 3D potrebbe non rilevare i tumori nel tessuto mammario denso1, 2, ritardando potenzialmente la diagnosi in queste pazienti. Sia il tessuto mammario denso che il cancro appaiono bianchi in una mammografia, creando un effetto mimetico pericoloso e un dilemma per i radiologi il cui obiettivo è individuare il cancro della mammella il prima possibile. Migliora il rilevamento del carcinoma mammario La mammografia potrebbe non rilevare oltre un terzo dei tumori laddove il tessuto mammario è particolarmente denso.1 Il sistema ABUS 2.0 (Automated Breast Ultrasound System) rappresenta quindi una pratica alternativa non ionizzante alle altre opzioni di screening per le donne con tessuto mammario denso. Se utilizzato in aggiunta alla mammografia, Invenia ABUS ha mostrato un relativo aumento nel rilevamento del cancro invasivo del 57% mantenendo un tasso di richiamo stabile del 2,3%.
Bibliografia [1] R.L. Siegel, K.D. Miller, H.E. Fuchs, A. Jemal, Cancer Statistics, 2021, CA. Cancer J. Clin. 71 (2021) 7–33. https://doi.org/10.3322/caac.21654. [2] E.D. Pisano, C. Gatsonis, E. Hendrick, M. Yaffe, J.K. Baum, S. Acharyya, E.F. Conant, L.L. Fajardo, L. Bassett, C. D’Orsi, R. Jong, M. Rebner, Digital Mammographic Imaging Screening Trial (DMIST) Investigators Group, Diagnostic performance of digital versus film mammography for breast-cancer screening, N. Engl. J. Med. 353 (2005) 1773–1783. https://doi.org/10.1056/NEJMoa052911. [3] C.H. Lee, J. Phillips, J.S. Sung, J.M. Lewin, M.S. Newell, Jordana Phillips, MD Janice S. Sung, MD John M. Lewin, MD Mary S. Newell, MD, (2022) 64. [4] M.S. Jochelson, M.B.I. Lobbes, Contrast-enhanced Mammography: State of the Art, Radiology. 299 (2021) 36– 48. https://doi.org/10.1148/radiol.2021201948. [5] V. Richter, V. Hatterman, H. Preibsch, S.D. Bahrs, M. Hahn, K. Nikolaou, B. Wiesinger, Contrast-enhanced spectral mammography in patients with MRI contraindications, Acta Radiol. Stockh. Swed. 1987. 59 (2018) 798– 805. https://doi.org/10.1177/0284185117735561. [6] Y.-C. Cheung, Y.-C. Lin, Y.-L. Wan, K.-M. Yeow, P.-C. Huang, Y.-F. Lo, H.-P. Tsai, S.-H. Ueng, C.-J. Chang, Diagnostic performance of dual-energy contrast-enhanced subtracted mammography in dense breasts compared to mammography alone: interobserver blind-reading analysis, Eur. Radiol. 24 (2014) 2394–2403. https://doi.org/10.1007/s00330-014-3271-1. [7] A. Cozzi, V. Magni, M. Zanardo, S. Schiaffino, F. Sardanelli, Contrast-enhanced Mammography: A Systematic Review and Meta-Analysis of Diagnostic Performance, Radiology. (2021) 211412. https://doi.org/10.1148/radiol.211412. [8] R.J. McDonald, J.S. McDonald, D.F. Kallmes, M.E. Jentoft, D.L. Murray, K.R. Thielen, E.E. Williamson, L.J. Eckel, Intracranial Gadolinium Deposition after Contrast-enhanced MR Imaging, Radiology. 275 (2015) 772– 782. https://doi.org/10.1148/radiol.15150025. [9] B.K. Patel, R.J. Gray, B.A. Pockaj, Potential Cost Savings of Contrast-Enhanced Digital Mammography, AJR Am. J. Roentgenol. 208 (2017) W231–W237. https://doi.org/10.2214/AJR.16.17239. [10] M.M. Hobbs, D.B. Taylor, S. Buzynski, R.E. Peake, Contrast-enhanced spectral mammography (CESM) and contrast enhanced MRI (CEMRI): Patient preferences and tolerance, J. Med. Imaging Radiat. Oncol. 59 (2015) 300–305. https://doi.org/10.1111/1754-9485.12296. [11] J. Phillips, M.M. Miller, T.S. Mehta, V. Fein-Zachary, A. Nathanson, W. Hori, R. Monahan-Earley, P.J. Slanetz, Contrast-enhanced spectral mammography (CESM) versus MRI in the high-risk screening setting: patient preferences and attitudes, Clin. Imaging. 42 (2017) 193–197. https://doi.org/10.1016/j.clinimag.2016.12.011. [12] D. Son, J. Phillips, T.S. Mehta, R. Mehta, A. Brook, V.M. Dialani, Patient preferences regarding use of contrastenhanced imaging for breast cancer screening, Acad. Radiol. (2021). https://doi.org/10.1016/j.acra.2021.03.003. [13] C. Dromain, C. Balleyguier, G. Adler, J.R. Garbay, S. Delaloge, Contrast-enhanced digital mammography, Eur. J. Radiol. 69 (2009) 34–42. https://doi.org/10.1016/j.ejrad.2008.07.035. [14] E.M. Fallenberg, C. Dromain, F. Diekmann, F. Engelken, M. Krohn, J.M. Singh, B. Ingold-Heppner, K.J. Winzer, U. Bick, D.M. Renz, Contrast-enhanced spectral mammography versus MRI: Initial results in the detection of breast cancer and assessment of tumour size, Eur. Radiol. 24 (2014) 256–264. https://doi.org/10.1007/s00330-013-3007-7. [15] M. Zanardo, A. Cozzi, R.M. Trimboli, O. Labaj, C.B. Monti, S. Schiaffino, L.A. Carbonaro, F. Sardanelli, Technique, protocols and adverse reactions for contrast-enhanced spectral mammography (CESM): a systematic review, Insights Imaging. 10 (2019) 76. https://doi.org/10.1186/s13244-019-0756-0. [16] C. Dromain, F. Thibault, F. Diekmann, E.M. Fallenberg, R.A. Jong, M. Koomen, R.E. Hendrick, A. Tardivon, A. Toledano, Dual-energy contrast-enhanced digital mammography: initial clinical results of a multireader, multicase study, Breast Cancer Res. BCR. 14 (2012) R94. https://doi.org/10.1186/bcr3210. [17] M.B.I. Lobbes, U.C. Lalji, P.J. Nelemans, I. Houben, M.L. Smidt, E. Heuts, B. de Vries, J.E. Wildberger, R.G. Beets-Tan, The quality of tumor size assessment by contrast-enhanced spectral mammography and the benefit of additional breast MRI, J. Cancer. 6 (2015) 144–150. https://doi.org/10.7150/jca.10705. [18] M.A. Francescone, M.S. Jochelson, D.D. Dershaw, J.S. Sung, M.C. Hughes, J. Zheng, C. Moskowitz, E.A. Morris, Low energy mammogram obtained in contrast-enhanced digital mammography (CEDM) is comparable to routine full-field digital mammography (FFDM), Eur. J. Radiol. 83 (2014) 1350–1355. https://doi.org/10.1016/j.ejrad.2014.05.015. [19] U.C. Lalji, C.R.L.P.N. Jeukens, I. Houben, P.J. Nelemans, R.E. van Engen, E. van Wylick, R.G.H. Beets-Tan, J.E. Wildberger, L.E. Paulis, M.B.I. Lobbes, Evaluation of low-energy contrast-enhanced spectral mammography images by comparing them to full-field digital mammography using EUREF image quality criteria, Eur. Radiol. 25 (2015) 2813–2820. https://doi.org/10.1007/s00330-015-3695-2. [20] M.A. Marino, D. Leithner, J. Sung, D. Avendano, E.A. Morris, K. Pinker, M.S. Jochelson, Radiomics for Tumor Characterization in Breast Cancer Patients: A Feasibility Study Comparing Contrast-Enhanced Mammography and Magnetic Resonance Imaging, Diagn. Basel Switz. 10 (2020). https://doi.org/10.3390/diagnostics10070492. [21] M.A. Marino, K. Pinker, D. Leithner, J. Sung, D. Avendano, E.A. Morris, M. Jochelson, Contrast-Enhanced Mammography and Radiomics Analysis for Noninvasive Breast Cancer Characterization: Initial Results, Mol. Imaging Biol. 22 (2020) 780–787. https://doi.org/10.1007/s11307-019-01423-5. [22] R. Fusco, A. Piccirillo, M. Sansone, V. Granata, M.R. Rubulotta, T. Petrosino, M.L. Barretta, P. Vallone, R. Di Giacomo, E. Esposito, M. Di Bonito, A. Petrillo, Radiomics and Artificial Intelligence Analysis with Textural Metrics Extracted by Contrast-Enhanced Mammography in the Breast Lesions Classification, Diagn. Basel Switz. 11 (2021). https://doi.org/10.3390/diagnostics11050815. [23] R. Massafra, S. Bove, V. Lorusso, A. Biafora, M.C. Comes, V. Didonna, S. Diotaiuti, A. Fanizzi, A. Nardone, A. Nolasco, C.M. Ressa, P. Tamborra, A. Terenzio, D. La Forgia, Radiomic Feature Reduction Approach to Predict Breast Cancer by Contrast-Enhanced Spectral Mammography Images, Diagn. Basel Switz. 11 (2021). https://doi.org/10.3390/diagnostics11040684. [24] Contrast Manual, (n.d.). https://www.acr.org/Clinical-Resources/Contrast-Manual (accessed June 2, 2021). [25] J. Sogani, E.A. Morris, J.B. Kaplan, D. D’Alessio, D. Goldman, C.S. Moskowitz, M.S. Jochelson, Comparison of Background Parenchymal Enhancement at Contrast-enhanced Spectral Mammography and Breast MR Imaging, Radiology. 282 (2017) 63–73. https://doi.org/10.1148/radiol.2016160284. [26] M. Carnahan, B. Pockaj, V. Pizzitola, M. Giurescu, R. Lorans, W. Eversman, R. Sharpe, P. Cronin, B.K. Patel, Contrast-Enhanced Mammography for Newly Diagnosed Breast Cancer in Women With Breast Augmentation: Preliminary Findings, AJR Am. J. Roentgenol. (2021). https://doi.org/10.2214/AJR.20.25341. [27] W.F. Sensakovic, M.B. Carnahan, C.D. Czaplicki, S. Fahrenholtz, A. Panda, Y. Zhou, W. Pavlicek, B. Patel, Contrast-enhanced Mammography: How Does It Work?, Radiogr. Rev. Publ. Radiol. Soc. N. Am. Inc. 41 (2021) 829–839. https://doi.org/10.1148/rg.2021200167. [28] N. Perry, M. Broeders, C. de Wolf, S. Törnberg, R. Holland, L. von Karsa, European guidelines for quality assurance in breast cancer screening and diagnosis. Fourth edition–summary document, Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 19 (2008) 614–622. https://doi.org/10.1093/annonc/mdm481. [29] J.R. James, W. Pavlicek, J.A. Hanson, T.F. Boltz, B.K. Patel, Breast Radiation Dose With CESM Compared With 2D FFDM and 3D Tomosynthesis Mammography, AJR Am. J. Roentgenol. 208 (2017) 362–372. https://doi.org/10.2214/AJR.16.16743. [30] M.S. Jochelson, D.D. Dershaw, J.S. Sung, A.S. Heerdt, C. Thornton, C.S. Moskowitz, J. Ferrara, E.A. Morris, Bilateral contrast-enhanced dual-energy digital mammography: feasibility and comparison with conventional digital mammography and MR imaging in women with known breast carcinoma, Radiology. 266 (2013) 743– 751. https://doi.org/10.1148/radiol.12121084. [31] M.D.M. Travieso-Aja, P. Naranjo-Santana, C. Fernández-Ruiz, W. Severino-Rondón, D. Maldonado-Saluzzi, M. Rodríguez Rodríguez, V. Vega-Benítez, O.P. Luzardo, Factors affecting the precision of lesion sizing with contrast-enhanced spectral mammography, Clin. Radiol. 73 (2018) 296–303. https://doi.org/10.1016/j.crad.2017.10.017. [32] K. Åhsberg, A. Gardfjell, E. Nimeus, R. Rasmussen, C. Behmer, S. Zackrisson, L. Ryden, Added value of contrast-enhanced mammography (CEM) in staging of malignant breast lesions-a feasibility study, World J. Surg. Oncol. 18 (2020) 100. https://doi.org/10.1186/s12957-020-01865-0. [33] E.Y. Kim, I. Youn, K.H. Lee, J.-S. Yun, Y.L. Park, C.H. Park, J. Moon, S.H. Choi, Y.J. Choi, S.-Y. Ham, S.H. Kook, Diagnostic Value of Contrast-Enhanced Digital Mammography versus Contrast-Enhanced Magnetic Resonance Imaging for the Preoperative Evaluation of Breast Cancer, J. Breast Cancer. 21 (2018) 453–462. https://doi.org/10.4048/jbc.2018.21.e62. [34] F. Amato, G. Bicchierai, D. Cirone, C. Depretto, F. Di Naro, E. Vanzi, G. Scaperrotta, T.V. Bartolotta, V. Miele, J. Nori, Preoperative loco-regional staging of invasive lobular carcinoma with contrast-enhanced digital mammography (CEDM), Radiol. Med. (Torino). 124 (2019) 1229–1237. https://doi.org/10.1007/s11547-019- 01116-7. [35] U.C. Lalji, I.P.L. Houben, R. Prevos, S. Gommers, M. van Goethem, S. Vanwetswinkel, R. Pijnappel, R. Steeman, C. Frotscher, W. Mok, P. Nelemans, M.L. Smidt, R.G. Beets-Tan, J.E. Wildberger, M.B.I. Lobbes, Contrast-enhanced spectral mammography in recalls from the Dutch breast cancer screening program: validation of results in a large multireader, multicase study, Eur. Radiol. 26 (2016) 4371–4379. https://doi.org/10.1007/s00330-016-4336-0. [36] A.-M. Tardivel, C. Balleyguier, A. Dunant, S. Delaloge, C. Mazouni, M.-C. Mathieu, C. Dromain, Added Value of Contrast-Enhanced Spectral Mammography in Postscreening Assessment, Breast J. 22 (2016) 520–528. https://doi.org/10.1111/tbj.12627. [37] M.F. Covington, Contrast-Enhanced Mammography Implementation, Performance, and Use for Supplemental Breast Cancer Screening, Radiol. Clin. North Am. 59 (2021) 113–128. https://doi.org/10.1016/j.rcl.2020.08.006. [38] M.S. Jochelson, K. Pinker, D.D. Dershaw, M. Hughes, G.F. Gibbons, K. Rahbar, M.E. Robson, D.A. Mangino, D. Goldman, C.S. Moskowitz, E.A. Morris, J.S. Sung, Comparison of screening CEDM and MRI for women at increased risk for breast cancer: A pilot study, Eur. J. Radiol. 97 (2017) 37–43. https://doi.org/10.1016/j.ejrad.2017.10.001. [39] V. Sorin, Y. Yagil, A. Yosepovich, A. Shalmon, M. Gotlieb, O.H. Neiman, M. Sklair-Levy, Contrast-Enhanced Spectral Mammography in Women With Intermediate Breast Cancer Risk and Dense Breasts, AJR Am. J. Roentgenol. 211 (2018) W267–W274. https://doi.org/10.2214/AJR.17.19355. [40] J.S. Sung, L. Lebron, D. Keating, D. D’Alessio, C.E. Comstock, C.H. Lee, M.C. Pike, M. Ayhan, C.S. Moskowitz, E.A. Morris, M.S. Jochelson, Performance of Dual-Energy Contrast-enhanced Digital Mammography for Screening Women at Increased Risk of Breast Cancer, Radiology. 293 (2019) 81–88. https://doi.org/10.1148/radiol.2019182660. [41] M.P. Hogan, T. Amir, V. Sevilimedu, J. Sung, E.A. Morris, M.S. Jochelson, Contrast-Enhanced Digital Mammography Screening for Intermediate-Risk Women With a History of Lobular Neoplasia, AJR Am. J. Roentgenol. 216 (2021) 1486–1491. https://doi.org/10.2214/AJR.20.23480. [42] X.-A. Phi, S. Saadatmand, G.H. De Bock, E. Warner, F. Sardanelli, M.O. Leach, C.C. Riedl, I. Trop, M.J. Hooning, R. Mandel, F. Santoro, G. Kwan-Lim, T.H. Helbich, M.M.A. Tilanus-Linthorst, E.R. van den Heuvel, N. Houssami, Contribution of mammography to MRI screening in BRCA mutation carriers by BRCA status and age: individual patient data meta-analysis, Br. J. Cancer. 114 (2016) 631–637. https://doi.org/10.1038/bjc.2016.32. [43] F. Sardanelli, F. Podo, F. Santoro, S. Manoukian, S. Bergonzi, G. Trecate, D. Vergnaghi, M. Federico, L. Cortesi, S. Corcione, S. Morassut, C. Di Maggio, A. Cilotti, L. Martincich, M. Calabrese, C. Zuiani, L. Preda, B. Bonanni, L.A. Carbonaro, A. Contegiacomo, P. Panizza, E. Di Cesare, A. Savarese, M. Crecco, D. Turchetti, M. Tonutti, P. Belli, A.D. Maschio, High Breast Cancer Risk Italian 1 (HIBCRIT-1) Study, Multicenter surveillance of women at high genetic breast cancer risk using mammography, ultrasonography, and contrast-enhanced magnetic resonance imaging (the high breast cancer risk italian 1 study): final results, Invest. Radiol. 46 (2011) 94–105. https://doi.org/10.1097/RLI.0b013e3181f3fcdf. [44] P.F.J. Gilbert, Breast Screening – Risk Adaptive Imaging for Density, clinicaltrials.gov, 2020. https://clinicaltrials.gov/ct2/show/NCT04097366 (accessed June 10, 2021). [45] S.L. Tennant, J.J. James, E.J. Cornford, Y. Chen, H.C. Burrell, L.J. Hamilton, C. Girio-Fragkoulakis, Contrastenhanced spectral mammography improves diagnostic accuracy in the symptomatic setting, Clin. Radiol. 71 (2016) 1148–1155. https://doi.org/10.1016/j.crad.2016.05.009. [46] Z. Lu, C. Hao, Y. Pan, N. Mao, X. Wang, X. Yin, Contrast-Enhanced Spectral Mammography Versus Ultrasonography: Diagnostic Performance in Symptomatic Patients with Dense Breasts, Korean J. Radiol. 21 (2020) 442–449. https://doi.org/10.3348/kjr.2019.0393. [47] A. Cozzi, V. Magni, M. Zanardo, S. Schiaffino, F. Sardanelli, Contrast-enhanced Mammography: A Systematic Review and Meta-Analysis of Diagnostic Performance, Radiology. 302 (2022) 568–581. https://doi.org/10.1148/radiol.211412. [48] V. Iotti, P. Giorgi Rossi, Contrast-Enhanced Mammography in Neoadjuvant Therapy Response Monitoring, in: M. Lobbes, M.S. Jochelson (Eds.), Contrast-Enhanc. Mammogr., Springer International Publishing, Cham, 2019: pp. 133–160. https://doi.org/10.1007/978-3-030-11063-5_8. [49] B.K. Patel, T. Hilal, M. Covington, N. Zhang, H.E. Kosiorek, M. Lobbes, D.W. Northfelt, B.A. Pockaj, ContrastEnhanced Spectral Mammography is Comparable to MRI in the Assessment of Residual Breast Cancer Following Neoadjuvant Systemic Therapy, Ann. Surg. Oncol. 25 (2018) 1350–1356. https://doi.org/10.1245/s10434-018-6413-x. [50] J. Gluskin, C. Rossi Saccarelli, D. Avendano, M.A. Marino, A.G.V. Bitencourt, M. Pilewskie, V. Sevilimedu, J.S. Sung, K. Pinker, M.S. Jochelson, Contrast-Enhanced Mammography for Screening Women after Breast Conserving Surgery, Cancers. 12 (2020). https://doi.org/10.3390/cancers12123495. [51] G. Bicchierai, J. Nori, D. De Benedetto, C. Boeri, E. Vanzi, S. Bianchi, M. Kaur Gill, D. Cirone, V. Miele, Role of contrast-enhanced spectral mammography in the post biopsy management of B3 lesions: Preliminary results, Tumori. 105 (2019) 378–387. https://doi.org/10.1177/0300891618816212. [52] G. Bicchierai, J. Nori, D. De Benedetto, C. Boeri, E. Vanzi, S. Bianchi, M. Kaur Gill, D. Cirone, V. Miele, Follow-up of B3 breast lesions without residual microcalcifications post vacuum-assisted biopsy, can contrastenhanced digital mammography help?, Breast J. 26 (2020) 299–302. https://doi.org/10.1111/tbj.13598.