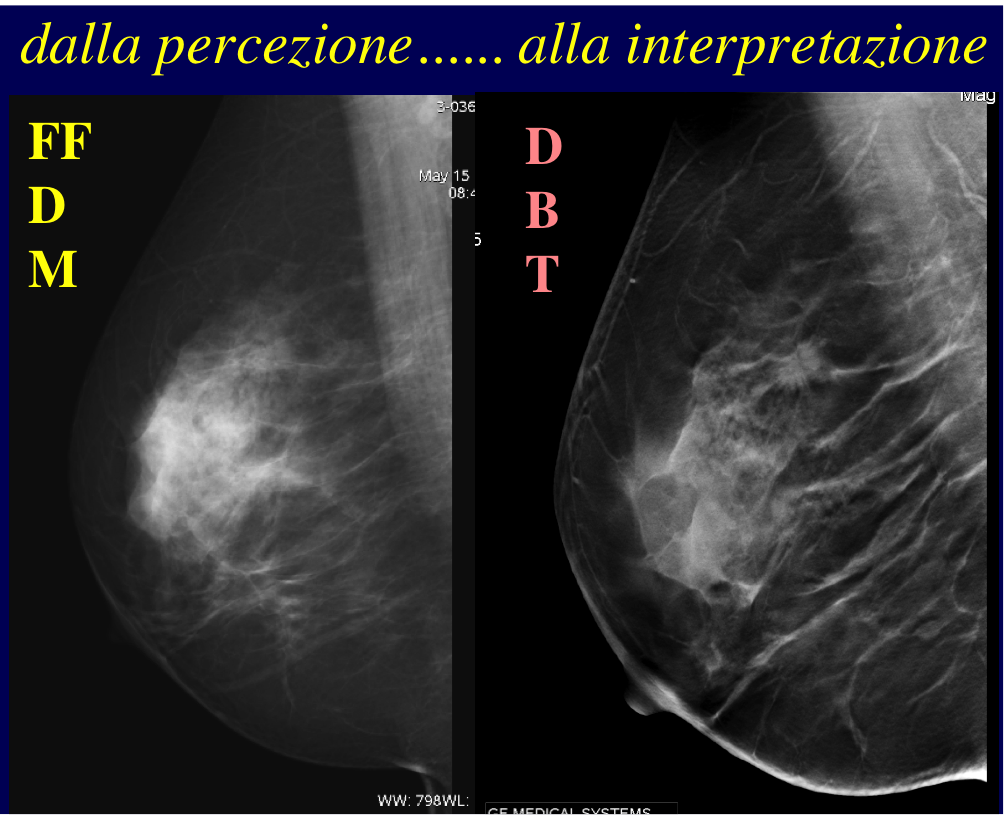
I costi della RM ed il 20-25% di falsi positivi ne limitano l’uso a casi quindi selezionati.
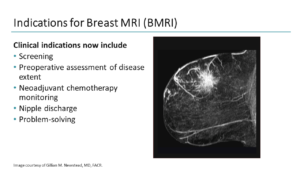
Le indicazioni principali della RM mammaria sono:
• Sorveglianza delle donne ad alto rischio:
Studi recenti hanno dimostrato l’utilità della RM con MdC nella sorveglianza delle donne ad alto rischio genetico-familiare di carcinoma mammario (soggetti con test genetico positivo per mutazione patogenica nel geni BRCA1, BRCA2 o TP53), indicando livelli di sensibilità superiori a quelli dell’imaging convenzionale e accettabili livelli di specificita.
Sulla base delle linee guida disponibili, si raccomanda l’esecuzione di RM con MdC a cadenza annuale nelle donne classificate ad alto rischio genetico-familiare di carcinoma mammario.
• Stadiazione locale pre-trattamento chirurgico:
la RM mammaria ha maggiore sensibilità, rispetto all’imaging convenzionale (mammografia ed ecografia), nella stadiazione locale del carcinoma mammario (dimensione della lesione, multifocalità, multicentricità, lesioni maligne controlaterali).
La non elevata specificità, tuttavia, richiede spesso ulteriori approfondimenti diagnostici (second-look ecografico con agobiopsia ecoguidata, eventuali biopsie RM-guidate).
• Valutazione dell’effetto della chemioterapia neoaudiuvante:
la RM può essere utilizzata nella valutazione dell’effetto della chemioterapia neoadiuvante nelle pazienti con carcinoma mammario localmente avanzato
• Mammella trattata per carcinoma:
La RM ha elevati livelli di specificità e sensibilità nella differenziazione tra recidiva locale (o residuo tumorale) e cicatrice chirurgica.
La sua esecuzione è indicata in pazienti con esame clinico e/o imaging convenzionale sospetti nelle seguenti condizioni:
– la biopsia percutanea non è tecnicamente eseguibile o ha scarse probabilità di essere risolutiva
– il quadro clinico e l’imaging convenzionale non sono risolutivi per l’identificazione dell’estensione della recidiva
• Carcinoma occulto:
in caso di diagnosi bioptica di metastasi (linfonodali o in altra sede) da probabile primitivo mammario con clinica e imaging convenzionale negative (CUP syndrome), la RM ha mostrato livelli elevati di sensibilità, visualizzando la lesione primitiva nel 50% circa dei casi.
La CUP syndrome rappresenta quindi una indicazione elettiva alla RM mammaria.
Se viene riscontrata una lesione sospetta alla RM si procederà a second-look ecografico e agobiopsia ecoguidata (RM guidata se la lesione non è visibile ecograficamente)
• Mammella secernente:
la RM ha elevata capacità di individuare lesioni in pazienti con secrezione del capezzolo dubbia o sospetta: può essere indicata, dopo mammografia ed ecografia, nei casi in cui la galattografia sia non eseguibile o non conclusiva
• Protesi:
la RM è molto più accurata, rispetto all’esame clinico e all’imaging convenzionale, nella valutazione dello stato dell’impianto e delle complicanze periprotesiche.
Costituiscono indicazioni alla RM senza MdC:
– il sospetto clinico di rottura protesica con imaging convenzionale negativo o non conclusivo;
– l’approfondimento diagnostico dopo imaging convenzionale positivo o dubbio per rottura.
Non vi sono evidenze a favore dell’impiego della RM nel controllo periodico di donne asintomatiche portatrici di protesi
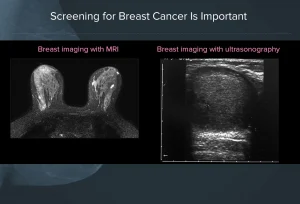
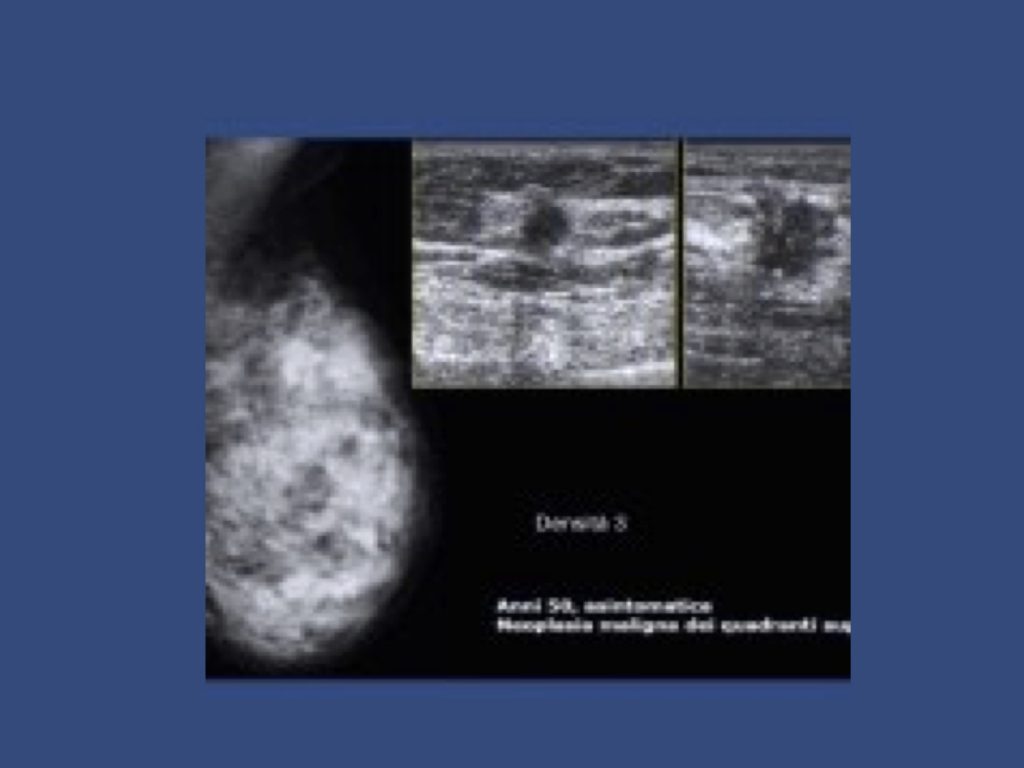
• Studio dei seni densi:
Valutazione di mammelle di difficile interpretazione alla mammografia o all’ecografia (seni densi e/o opachi).
Onde evitare falsi positivi si raccomanda l’esecuzione della RM dal 7’o al 14’o giorno dall’inizio delle mestruazioni e nelle donne in menopausa dopo un mese di sospensione della eventuale terapia ormonale sostitutiva.
L’esame va effettuato con mezzo di contrasto eccetto nei casi di protesi.
Ulteriore indicazione di RM prechirurgica riguarda i casi di tumori multifocali, multicentrici o sospetti di tumore controlaterale.
Queste quindi le indicazioni principali per l’esame di risonanza magnetica mammaria (RMM) secondo le linee guida definite della letteratura medico scientifica internazionale:
- donne a elevato rischio genetico-familiare per carcinoma mammario;
- ricerca di carcinoma primitivo occulto metastatico di sospetta origine mammaria, con esami tradizionali negativi;
- ricerca di multicentricità, multifocalità, bilateralità, in caso di neoplasie già diagnosticate con tecniche tradizionali e candidate a chirurgia conservativa (quadrantectomia);
- valutazione di neoplasie mammarie trattate con chemioterapia neoadiuvante;
- follow up dopo chirurgia conservativa, per discriminare tra recidiva o tessuto cicatriziale;
- valutazione di donne con protesi;
- discrepanza tra indagini e/o difficoltosa interpretazione di indagini diagnostiche tradizionali (ecografia e mammografia).
Criticità
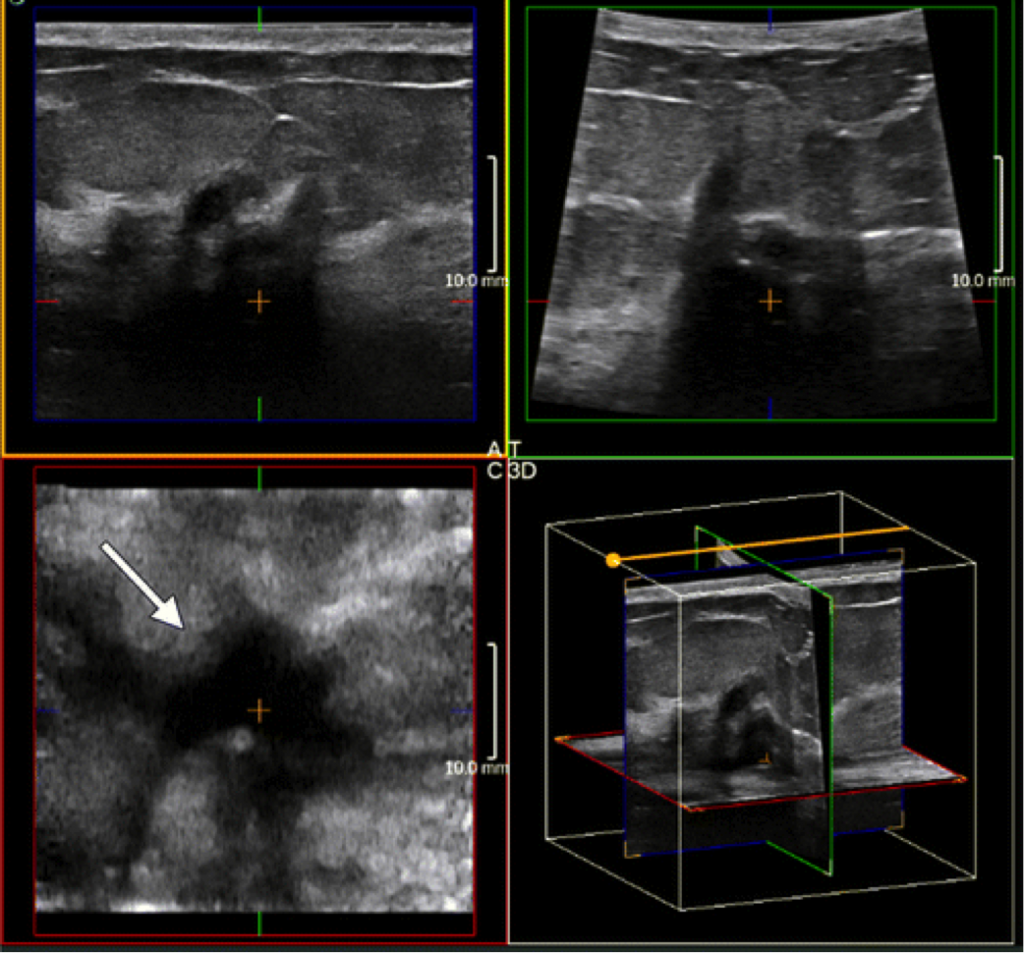
- On breast MRIs, oval/round masses, masses with T2 hyperintense enhancement, and non-mass lesions with homogeneous enhancement patterns are unlikely to be malignant and are more likely to yield false positive results.
- Use of breast MRI as a screening tool is limited by the high rate of false positives.
- The current findings can help reduce this risk by identifying features associated with false positives.
- Foregoing biopsy when these features are present can reduce patient anxiety and save healthcare dollars.
Study Design
- The team correlated the MRI findings and pathology results of 219 women (median age, 49 years) who had undergone biopsy of lesions detected by MRI.
- MRI findings were reviewed by two breast-trained radiologists.
Key Results
- Indications for MRI included screening (48% of women), staging (29%), and surveillance after malignant lumpectomy (9%).
- MRI-guided biopsies were performed for 219 patients; 62.5% of lesions were benign, 19.6% were high-risk, and 18% were malignant.
- The rate of false positive findings was 82.2%.
- Malignant lesions were slightly more likely among older patients (odds ratio [OR], 1.05; P = .0015).
- Irregularly shaped masses vs oval/round ones were over 11 times more likely to be malignant (OR, 11.2; P = .015).
- There was a significantly greater likelihood of false positive results with T2-hyperintense masses (OR, 0.13, P = .024).
- For non-mass lesions, those showing enhancements with clumped/clustered ring patterns, in comparison with homogeneous patterns, were more than three times more likely to be malignant (OR, 3.22).
PET mammaria
Il vantaggio principale dell’imaging PET è che malattie come il cancro spesso si manifestano per la prima volta come metabolismo disordinato prima che si possano vedere cambiamenti anatomici. [6, 7] Inoltre, il tessuto mammario denso o le cicatrici possono causare l’indeterminato delle tecniche anatomiche (mammografia, risonanza magnetica, ecografia). In questi casi, sapere se una struttura anatomica è ipermetabolica al glucosio può essere fondamentale per determinare una corretta gestione medica. [8, 9]
Breast PET utilizza tipicamente il radiotracciante F-18 fluorodeossiglucosio (F-18 FDG) per visualizzare il metabolismo del glucosio [10, 11]; tuttavia, altri radiotraccianti sono in fase di sviluppo.
Le telecamere PET per tutto il corpo sono in genere combinate con uno scanner CT per consentire l’acquisizione di informazioni anatomiche e molecolari da una singola procedura. Queste telecamere ibride PET/CT sono a forma di ciambella. Durante la procedura, il paziente viene fatto passare attraverso il foro centrale della telecamera. La mammografia ad emissione di positroni (PEM), richiede che la telecamera PET sia configurata come una macchina per mammografia. Le telecamere PEM utilizzano due piccoli rilevatori piatti mobili che vengono premuti direttamente contro il seno.
La tecnologia della fotocamera utilizzata da PEM ha dimostrato di essere più sensibile dell’imaging PET/CT di tutto il corpo nella rilevazione dei tumori al seno. [1, 4]Tomografia a emissione di positroni mammari
All’arrivo nella struttura lo zucchero nel sangue del paziente viene controllato. Se è elevato, potrebbe essere necessario riprogrammare la scansione. Se si trova in un intervallo accettabile (generalmente 7-8 mmol/L, ≤140 mg/dL), al paziente vengono iniettati circa 370 MBq di tracciante.
Dopo l’iniezione di tracciante, la persona riposerà tranquillamente per circa un’ora, per dare il tempo al radiotracciante di essere assorbito dal tessuto ipermetabolico.
Dopo questo periodo di assorbimento, si ottengono immagini obliqui craniocaudali e mediolaterali bilaterali di 10 minuti del seno. [17]
scansione PET del seno viene attualmente eseguita con una telecamera PET portatile, che consiste in due piastre piatte della fotocamera tra le quali il seno viene posizionato durante la scansione. Le piastre della fotocamera sono mobili per consentire diverse posizioni di imaging. Il campo visivo è di circa 16 cm x 24 cm e la risoluzione spaziale è di circa 1-3 mm. Sebbene le lastre di imaging siano piatte, si ottengono immagini tomografiche tridimensionali.
Gli scanner PET funzionano rilevando i fotoni rilasciati dopo che una particella di decadimento dei positroni dal radionuclide si annienta con un elettrone. Quando i fotoni colpiscono il cristallo di rilevamento, viene emessa una piccola quantità di luce. Questa luce viene quindi convertita in forma digitale per l’interpretazione. Attualmente, i cristalli pixilati di orthosilicato di ittrio di lutezio (LYSO) vengono utilizzati per il rilevamento dei fotoni. [16]
|
RispondiInoltra
|